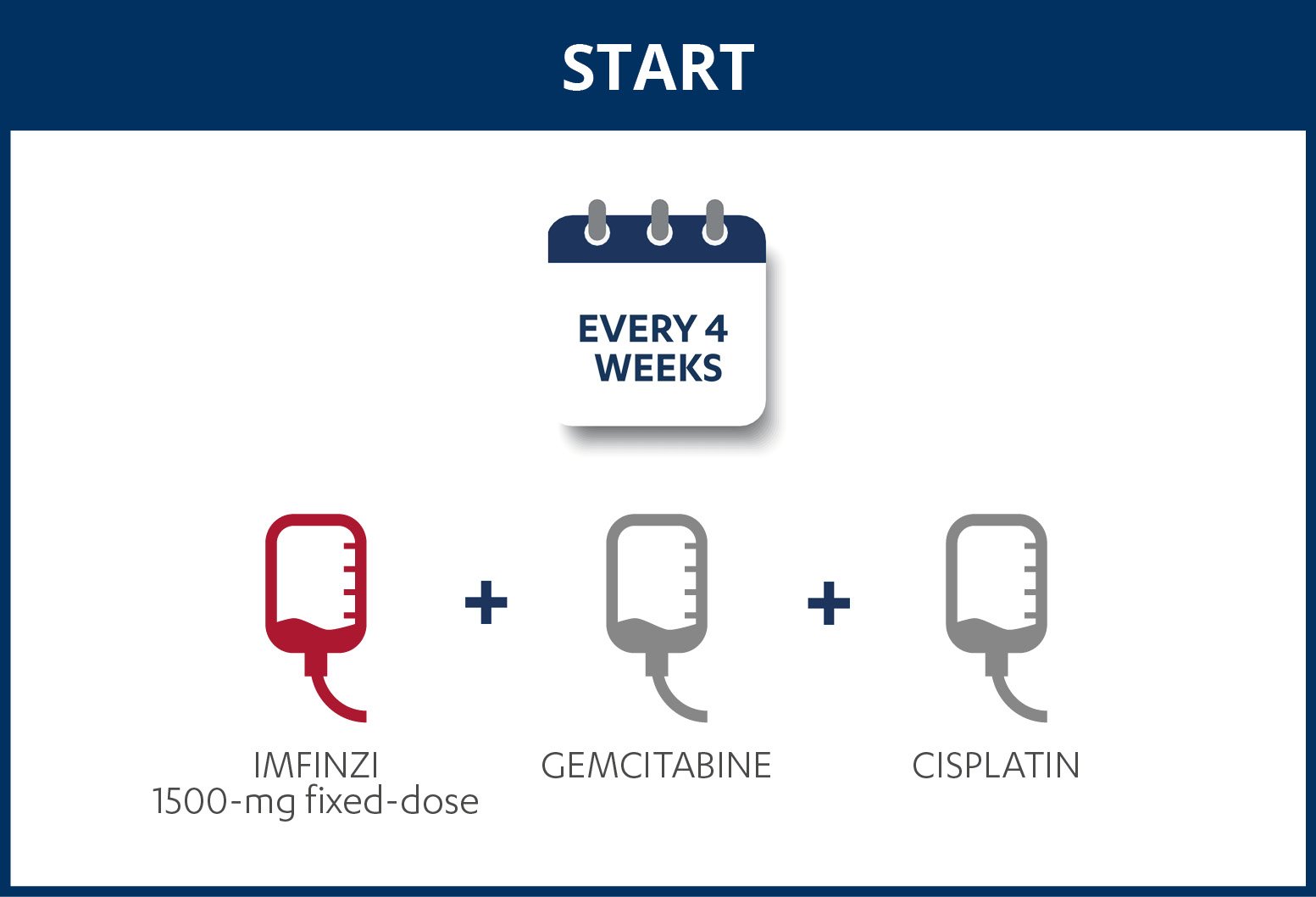
Det enda sättet att bota gallvägscancer är genom att operera bort tumören. Har cancern spridit sig kan den inte botas men cancersymtom kan alltid behandlas4.
TOPAZ-1-studie
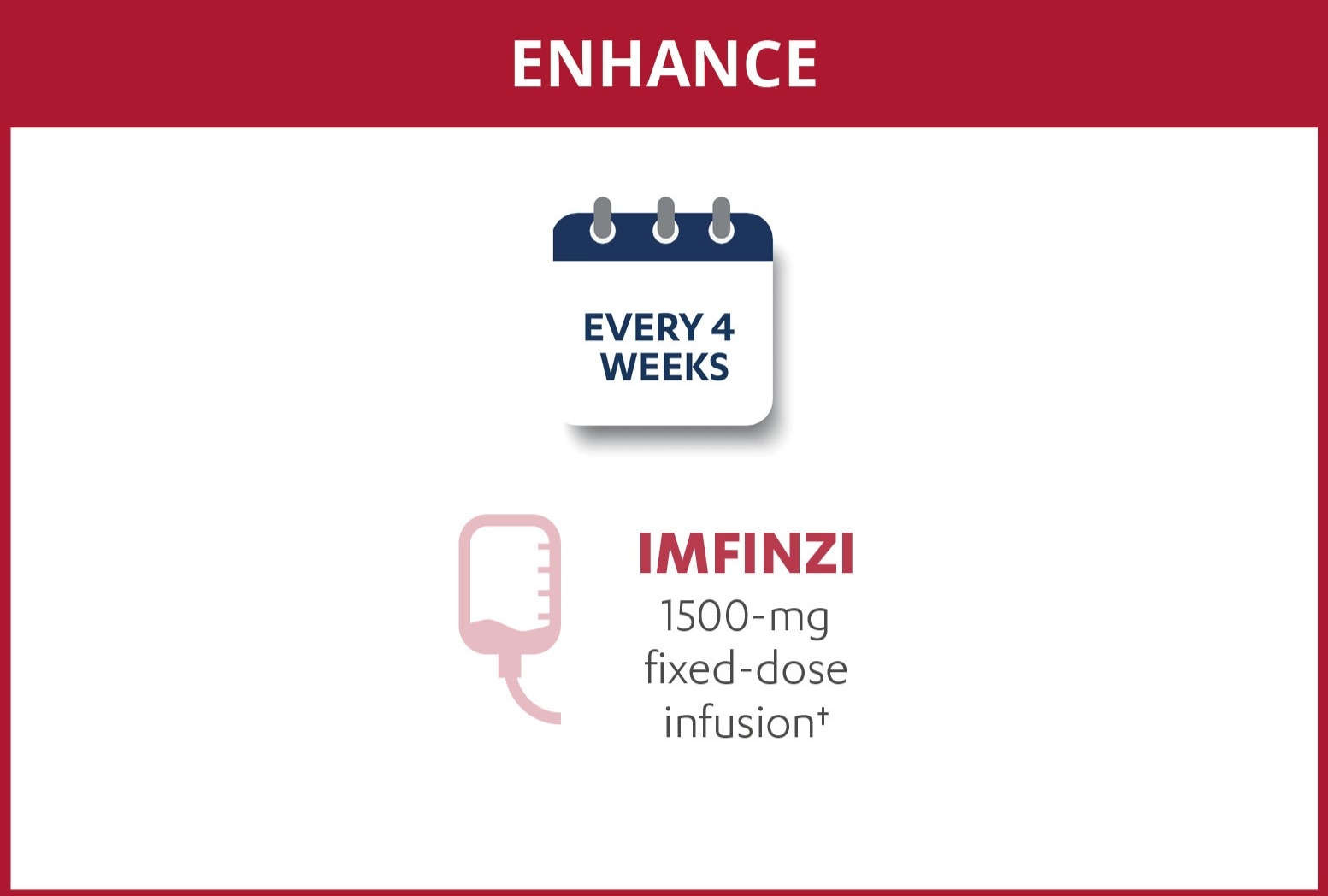
IMFINZI (durvalumab) i kombination med gemcitabin och cisplatin är avsett för första linjens behandling av vuxna med icke-resektabel eller metastaserad gallvägscancer (BTC)5. I fas III-studien TOPAZ-1 utvärderades IMFINZI i kombination med cytostatika (gemcitabin och cisplatin) jämfört med placebo i kombination med cytostatika (gemcitabin och cisplatin) som första linjens behandling. TOPAZ-1 är en randomiserad och placebokontrollerad studie.
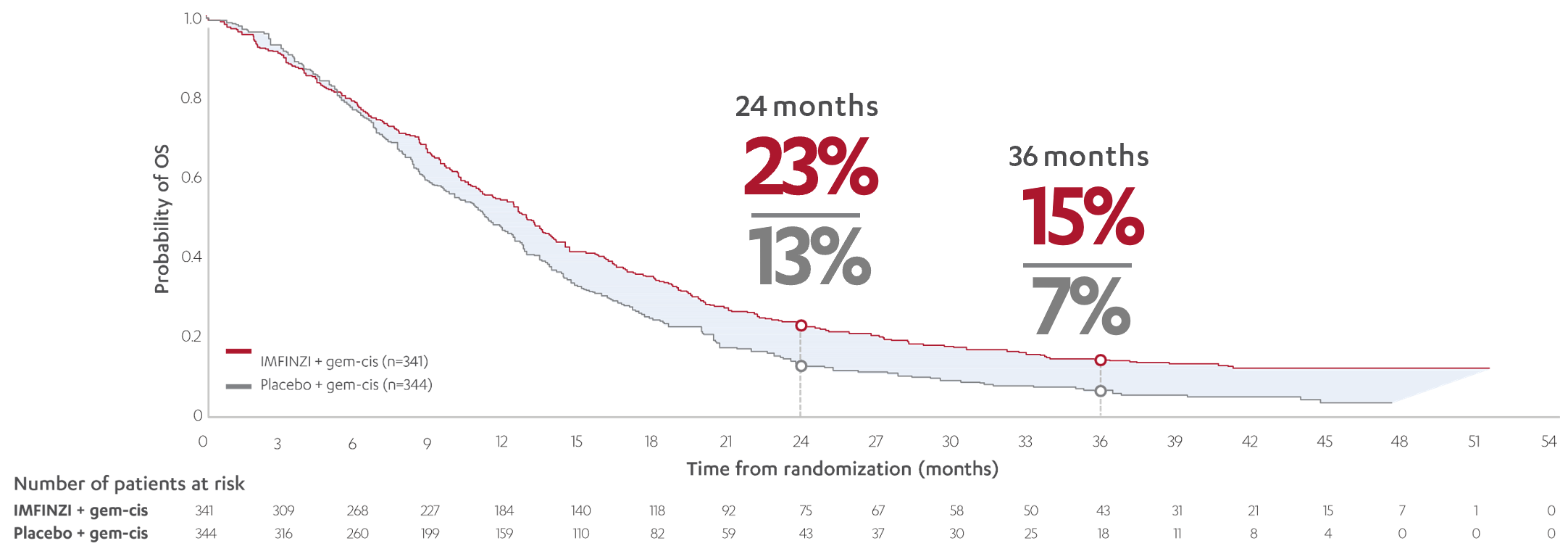
Resultaten från studien visade att IMFINZI i kombination med gemcitabin och cisplatin signifikant förbättrade totalöverlevnad (OS) i jämförelse med placebo. Behandlingen hade en acceptabel säkerhetsprofil och andelen biverkningar av grad 3 och 4 var liknande med IMFINZI och cytostatika jämfört med placebo6. Uppdaterade explorativa resultat av fas III-studien TOPAZ-1 efter tre år visade robust och fortsatt fördelaktig OS. Median-OS var 12,9 månader för IMFINZI i kombination med cytostatika jämfört med 11,3 månader med placebo. Mer än dubbelt så många patienter som fick IMFINZI i kombination med gemcitabin och cisplatin var vid liv vid tre-års-uppföljningen jämfört med placebo (HR 0,74; 95 % CI 0,63 - 0,87, analysen var en ej för-planerad statistisk analys och därav fanns inget p-värde) (graf 1). Inga nya säkerhetssignaler upptäcktes vid tre-års-uppföljningen7.
I en Real World-analys undersöktes effektivitet och säkerhet av durvalumab i kombination med cytostatika i den kliniska vardagen. Data bekräftade mestadels resultaten från TOPAZ-1-studien när det gällde bland annat progressionsfri överlevnad och säkerhet8.
Lär dig mer om TOPAZ-1-studien
I fas III-studien TOPAZ-1 utvärderades IMFINZI i kombination med gemcitabin och cisplatin för behandling av vuxna med icke-resektabel eller metastaserad gallvägscancer (BTC).
Lär dig mer om viktiga fynd från TOPAZ-1 i videon nedan.