Lynparza© (olaparib)
Antineoplastiska läkemedel, övriga antineoplastiska läkemedel, PARP-hämmare.
ATC-kod: L01XK01 Filmdragerade tabletter 100 och 150 mg. Rx.
Filmdragerade tabletter 100 och 150 mg.
Indikationer:
Äggstockscancer:
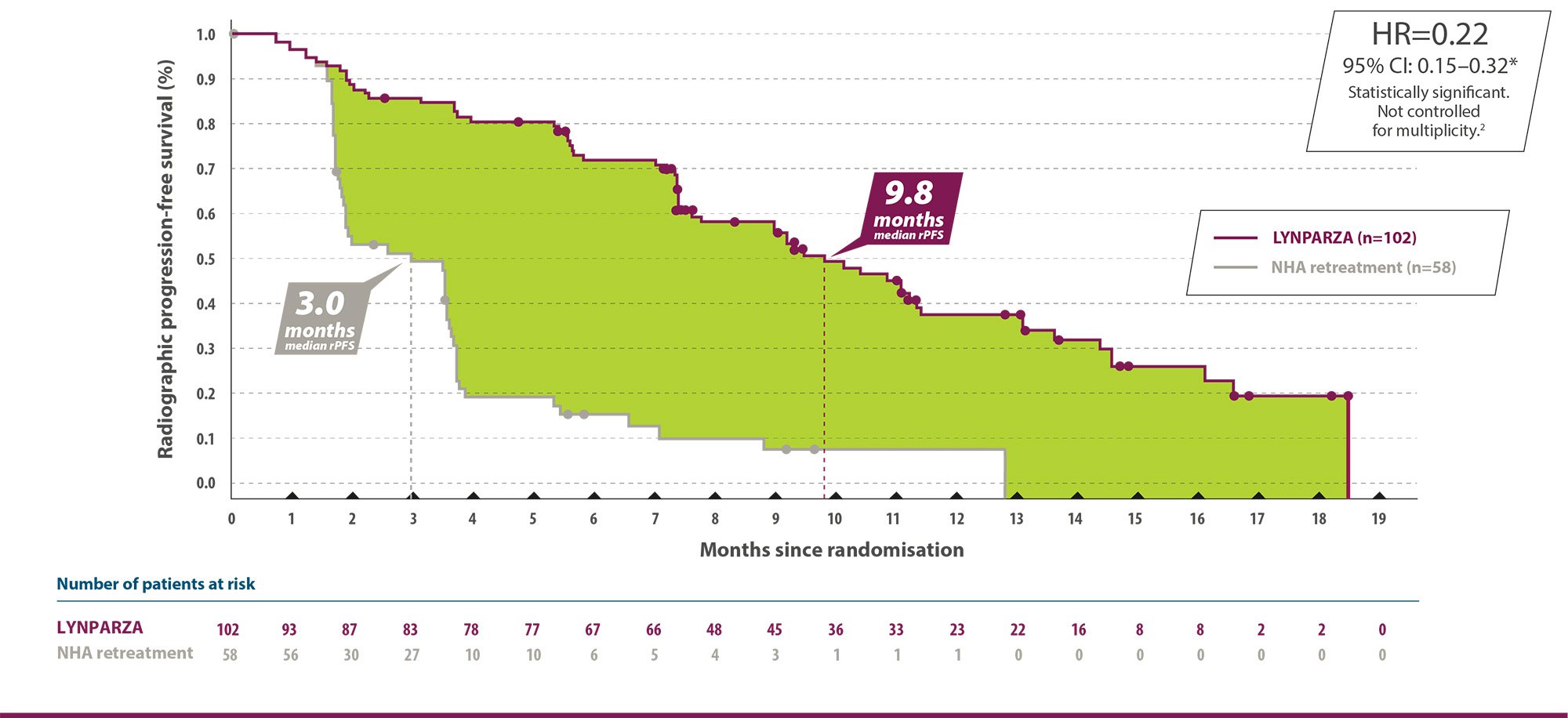
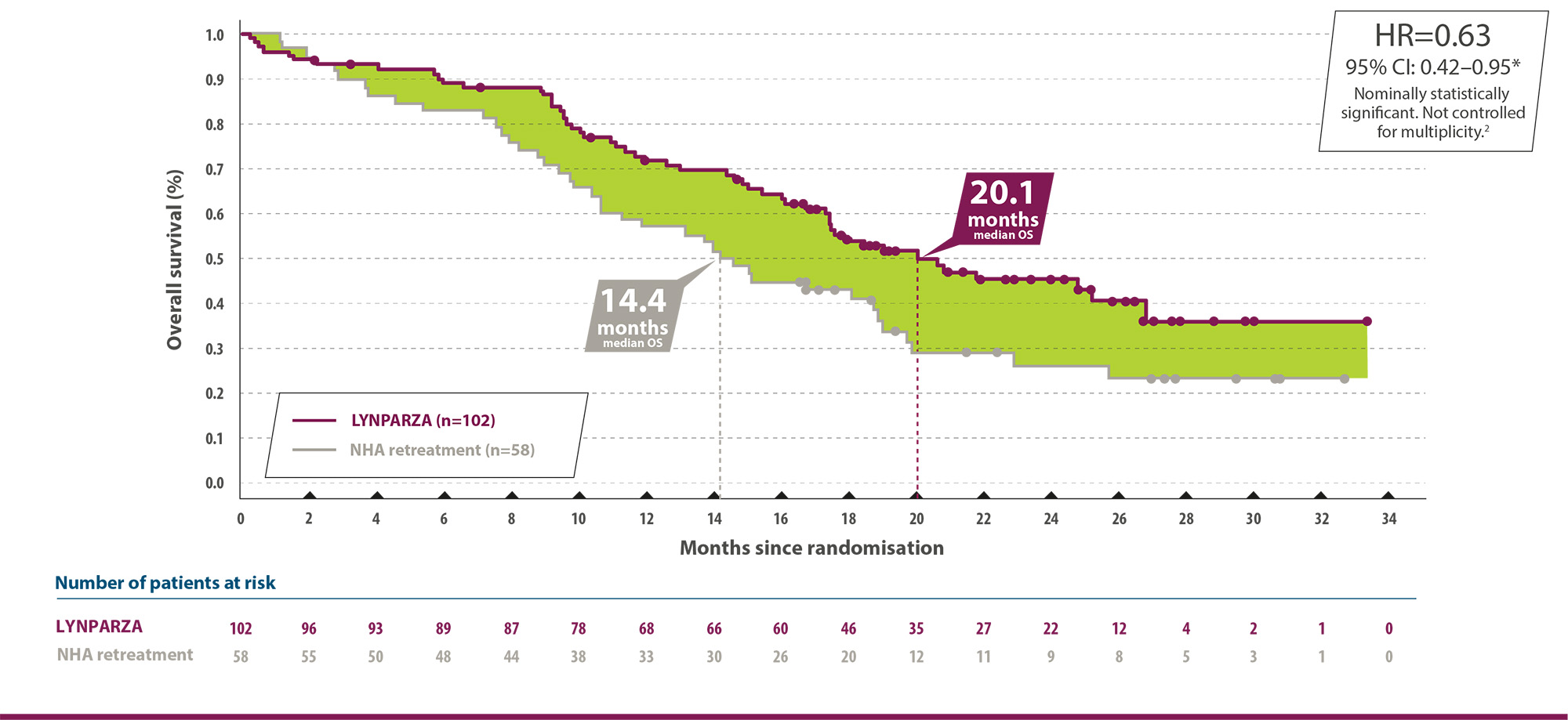
1) Lynparza tabletter är indicerade som monoterapi för underhållsbehandling av vuxna patienter med avancerad (FIGO stadie III och IV) BRCA1/2-muterad (nedärvd och/eller somatisk) höggradig epitelial ovarial-, tubar- eller primär peritonealcancer som är i respons (komplett eller partiell) efter avslutad första linjens platinumbaserad cytostatikabehandling.
(F) = ingår i förmånen med begränsning, subventioneras vid ovanstående indikation.
2) Lynparza tabletter i kombination med bevacizumab är indicerade som underhållsbehandling av vuxna patienter med avancerad (FIGO stadie III och IV) höggradig epitelial ovarial-, tubar- eller primär peritonealcancer som är i respons (komplett eller partiell) efter avslutad första linjens platinumbaserad cytostatikabehandling i kombination med bevacizumab och vars cancer är associerad med en positiv status för defekt homolog rekombination (HRD) som definieras antingen av en BRCA1/2-mutation och/eller genomisk instabilitet.
(F) = ingår i förmånen med begränsning, subventioneras vid ovanstående indikation.
3) Lynparza tabletter är indicerade som monoterapi för underhållsbehandling av vuxna patienter med platinumkänslig recidiverande höggradig epitelial ovarial-, tubar- eller primär peritonealcancer och som är i respons (komplett eller partiell) efter platinumbaserad cytostatikabehandling.
EF = Ingår inte i förmånen.
Bröstcancer:
1) Lynparza tabletter är indicerade som monoterapi för behandling av vuxna patienter med medfödd BRCA1/2‑mutation som har HER2‑negativ lokalt avancerad eller metastaserad bröstcancer. Patienter ska tidigare ha behandlats med en antracyklin och en taxan som (neo)adjuvant behandling eller som behandling för metastaserad sjukdom, såvida inte patienterna var olämpliga för dessa behandlingar. Patienter med hormonreceptor (HR)‑positiv bröstcancer ska också ha progredierat under eller efter tidigare endokrin behandling eller anses olämpliga för endokrin behandling.
EF = Ingår inte i förmånen.
2) Lynparza tabletter är indicerade som monoterapi eller i kombination med endokrin terapi som adjuvant behandling av vuxna patienter med nedärvd BRCA1/2-mutation som har HER2-negativ tidig bröstcancer med hög risk som tidigare behandlats med neoadjuvant eller adjuvant kemoterapi.
EF = Ingår inte i förmånen.
Adenokarcinom i pankreas:
Lynparza tabletter är indicerade som monoterapi för underhållsbehandling av vuxna patienter med nedärvda BRCA1/2‑mutationer som har metastaserande adenokarcinom i pankreas och som inte har progredierat efter minst 16 veckors platinumbehandling inom en första linjens cytostatikaregim.
EF = Ingår inte i förmånen.
Prostatacancer:
1) Lynparza tabletter är indicerade som monoterapi för behandling av vuxna patienter med metastaserande kastrationsresistent prostatacancer och BRCA1/2-mutationer (nedärvd och eller somatisk) som har progredierat efter tidigare behandling som inkluderade typen nya hormonella läkemedel.
(F) = Ingår i förmånen med begränsning, subventioneras vid ovanstående indikation och där behandling med docetaxel, kabazitaxel och radium-223 gett otillräcklig effekt eller inte är lämplig
2) Lynparza tabletter i kombination med abirateron och prednison eller prednisolon för behandling av vuxna patienter med mCRPC hos vilka kemoterapi inte är kliniskt indicerad
EF = Ingår inte i förmånen.
Dosering: Behandling med Lynparza ska initieras och övervakas av läkare med erfarenhet av cancerläkemedel.
Kontraindikationer: Överkänslighet mot den aktiva substansen eller mot något hjälpämne. Amning under behandlingen och 1 månad efter den sista dosen.
Varningar och försiktighet:
Lynparza får inte användas under graviditet.
Hematologisk toxicitet: Provtagning vid initiering av behandlingen och därefter månatliga kontroller av fullständig blodstatus rekommenderas under de första 12 behandlingsmånaderna och därefter med jämna mellanrum. Om en patient får allvarlig hematologisk toxicitet eller är beroende av blodtransfusioner, ska behandlingen med Lynparza avbrytas och lämpliga blodtester göras.
Myelodysplastiskt syndrom/akut myeloisk leukemi: Om MDS/AML misstänks ska patienten remitteras till en hematolog för vidare utredning, inklusive benmärgsanalys och blodprovtagning för cytogenetik. Om MDS/AML bekräftas efter utredning avseende långvarig hematologisk toxicitet ska Lynparza sättas ut och patienten ska erhålla lämplig behandling.
Senaste översyn av Produktresumén: 2023-03-30
För ytterligare information och priser se www.fass.se.
AstraZeneca AB, 151 85 Södertälje tel: 08 – 553 260 00. www.astrazeneca.se
AstraZeneca och MSD är i en allians för att
utveckla och marknadsföra Lynparza.