IMFINZI (durvalumab)
Verkningsmekanism2
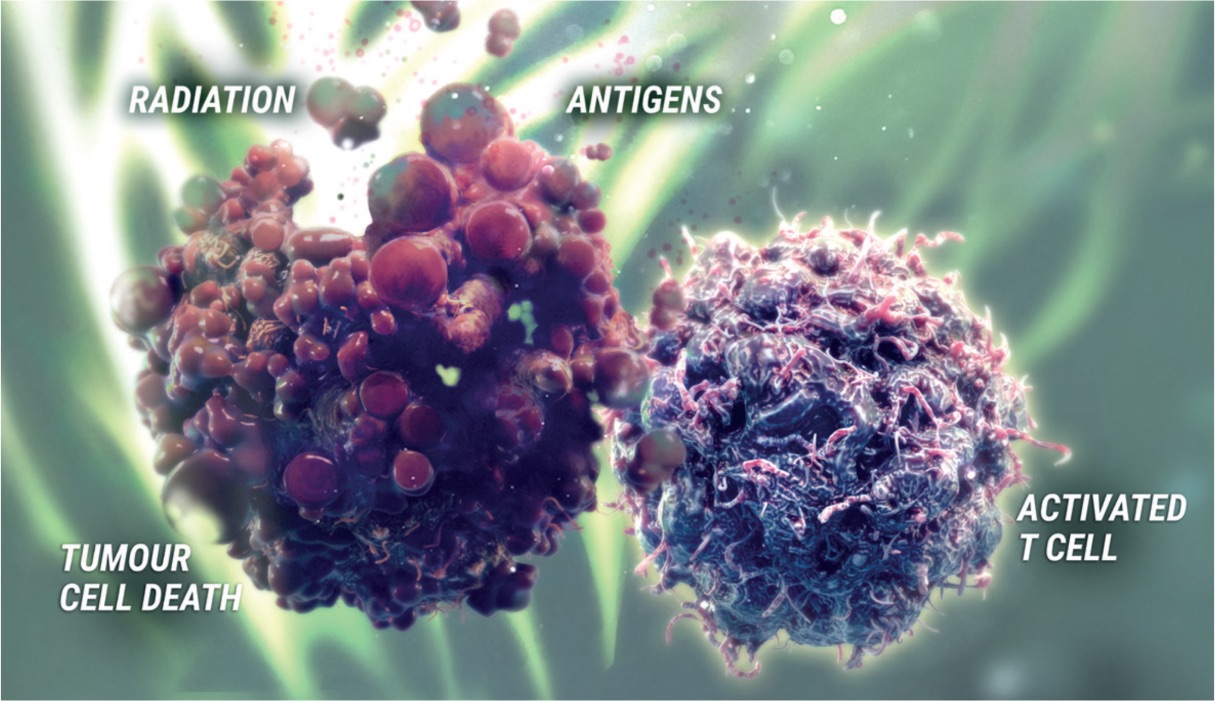
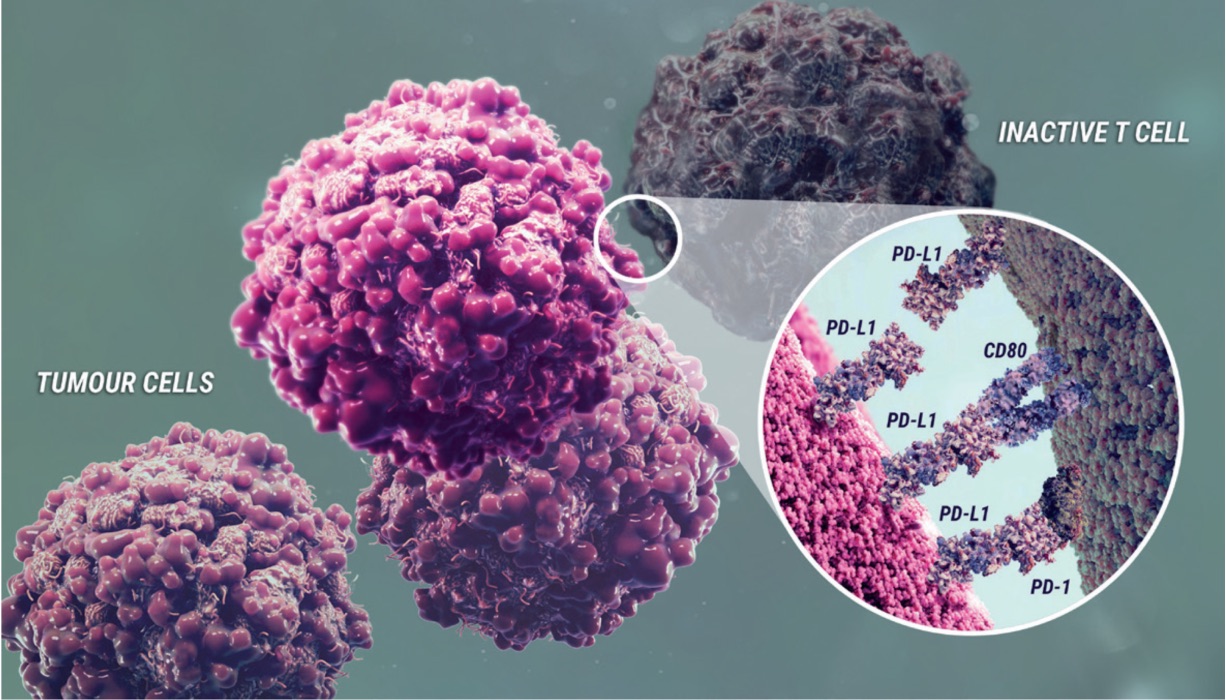
Uttryck av liganden (proteinet) för programmerad celldöd (PD‐L1) är ett adaptivt immunsvar som hjälper tumörer att undvika upptäckt och eliminering av immunsystemet. PD‐L1 kan induceras av inflammatoriska signaler (t.ex. IFN‐gamma) och kan uttryckas på både tumörceller och tumörassocierade immunceller i tumörens mikromiljö. PD‐L1 blockerar T‐cellers funktion och aktivering via interaktion med PD‐1 och CD80 (B7.1). Genom att binda till dess receptorer reducerar PD‐L1 cytotoxisk T‐cellsaktivitet, proliferation och cytokinproduktion.
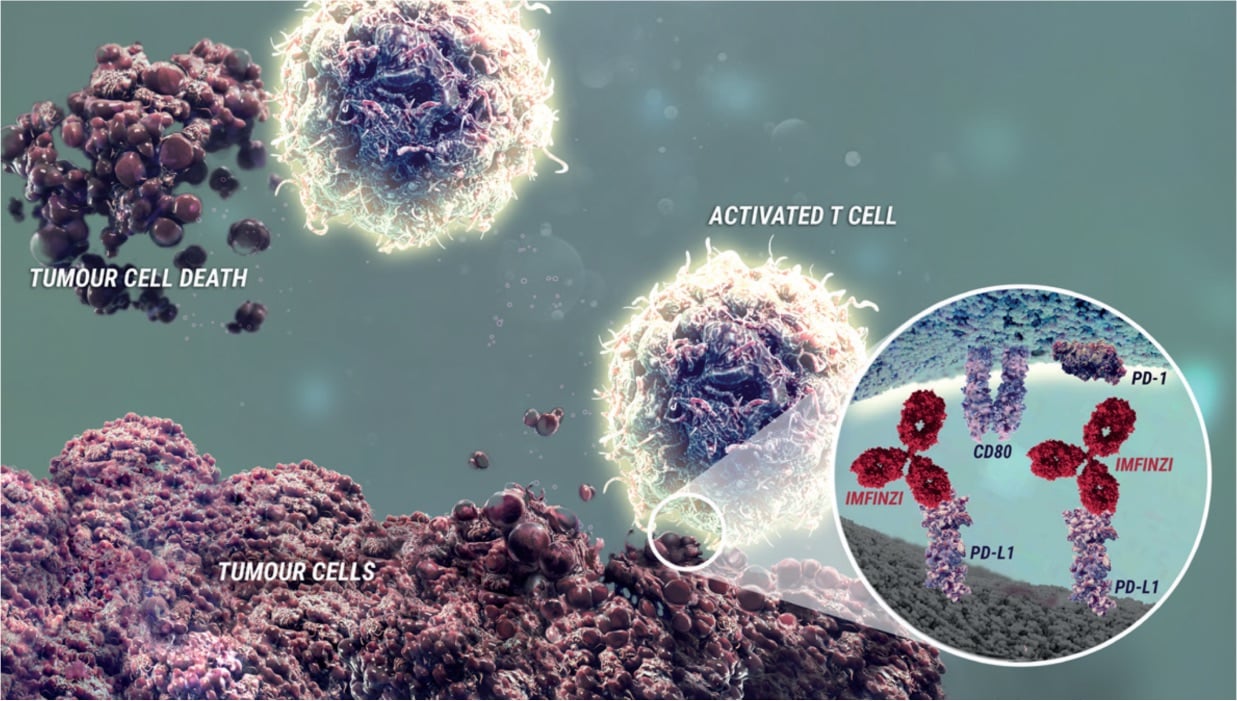
Durvalumab är en helt human, imunglobulin G1‐kappa (IgG1κ) monoklonal antikropp som selektivt blockerar interaktionen mellan PD‐L1 och PD‐1 respektive CD80 (B7.1). Durvalumab inducerar inte antikroppsberoende cellmedierad cytotoxicitet (ADCC). Selektiv blockad av interaktioner mellan PD‐L1/PD‐1 och PD‐L1/CD80 förstärker antitumörimmunsvar och ökar T-cellsaktiveringen.
Kombinationen av tremelimumab (en CTLA-4-hämmare) och durvalumab (en PD-LI-hämmare) verkar för att öka antitumör-T-cellsaktiveringen och -funktionen i flera stadier av immunsvaret, vilket resulterar i bättre antitumörsvar. I murina syngena tumörmodeller resulterade dubbelblockad av PD-L1 och CTLA-4 i ökad antitumöraktivitet.
Effekt och säkerhet2
Icke-småcellig lungcancer (NSCLC)
IMFINZI som monoterapi är indicerat för behandling av lokalt avancerad, icke-resektabel icke-småcellig lungcancer (NSCLC) hos vuxna vilkas tumörer uttrycker PD‑L1 på ≥ 1 % av tumörceller och vilkas sjukdom inte har progredierat efter platinum-baserad radiokemoterapi (CRT)
Patienter med lokalt avancerad NSCLC ska utvärderas för behandling baserat på tumöruttryck av PD-L1 som bekräftats med en validerad analysmetod.
Dosering vid monoterapi, lokalt avancerad NSCLC: 10 mg/kg varannan vecka eller 1 500 mg var fjärde vecka.
Varaktighet av behandlingen: Fram till sjukdomsprogression, oacceptabel toxicitet eller i högst 12 månader.
Säkerhetsprofilen för IMFINZI som monoterapi är baserad på poolade data från 4 045 patienter med olika tumörtyper. De vanligaste (> 10 %) biverkningarna var hosta/produktiv hosta (18,7 %), diarré (16,1 %), utslag (15,5 %), artralgi (13,8 %), pyrexi (13,0 %), buksmärta (13,0 %), övre luftvägsinfektioner (12,1 %), pruritus (11,4 %) och hypotyreoidism (10,9 %). De vanligaste (> 2 %) biverkningarna av grad ≥ 3 enligt National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE) var pneumoni (3,6 %) och förhöjt aspartataminotransferas/alaninaminotransferas (2,9 %).
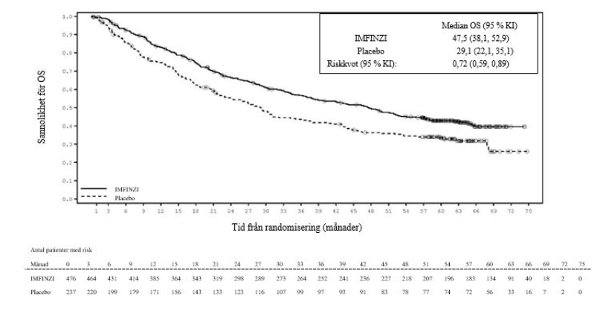
Kaplan-Meier-kurva för OS uppföljningsanalysen efter 5 år, exploratorisk analys.
Småcellig lungcancer (SCLC)
IMFINZI i kombination med etoposid och antingen karboplatin eller cisplatin är indicerat för första linjens behandling av vuxna med avancerad småcellig lungcancer (ES-SCLC).
Dosering vid ES-SCLC: 1 500 mg i kombination med cytostatika var tredje vecka (21 dagar) i 4 cykler, följt av 1 500 mg var fjärde vecka som monoterapi.
Varaktighet av behandlingen: Fram till sjukdomsprogression eller oacceptabel toxicitet.
När IMFINZI administreras i kombination med cytostatikabehandling, se produktresumén för etoposid, nab-paklitaxel, gemcitabin, pemetrexed och karboplatin eller cisplatin för information om dosering
Säkerheten av IMFINZI i kombination med cytostatika baseras på poolade data från 603 patienter från 2 studier (TOPAZ-1 och CASPIAN). De vanligaste (> 10 %) biverkningarna var neutropeni (53,1 %), anemi (43,9 %), illamående (37,5 %), trötthet (36,8 %), trombocytopeni (28,0 %), förstoppning (25,4 %), minskad aptit (22,6 %), buksmärta (18,4 %), alopeci (18,4 %), leukopeni (17,2 %), kräkningar (16,9 %), pyrexi (15,1 %), hudutslag (14,8 %), diarré (13,8 %), förhöjt aspartataminotransferas/alaninaminotransferas (10,9 %), hosta/produktiv hosta (10,8 %) och pruritus (10,4 %). De vanligaste (> 2 %) biverkningarna av grad ≥ 3 enligt NCI CTCAE var neutropeni (35,2 %), anemi (17,4 %), trombocytopeni (11,1 %), leukopeni (7,1 %), trötthet (5,0 %), febril neutropeni (3,0 %), förhöjt aspartataminotransferas/alaninaminotransferas (2,8 %) och pneumoni (2,5%).
Kaplan-Meier-kurva för OS uppföljningsanalysen, exploratorisk analys.

Allmän information:
Behandling måste sättas in och övervakas av en läkare med erfarenhet av cancerbehandling.
IMFINZI administreras som en intravenös infusion under 1 timme.
Patienter med en kroppsvikt på 30 kg eller lägre måste få viktbaserad dos, ekvivalent till IMFINZI 10 mg/kg varannan vecka eller 20 mg/kg var fjärde vecka som monoterapi tills vikten ökat till över 30 kg.
Det rekommenderas att man fortsätter med behandlingen hos kliniskt stabila patienter med begynnande tecken på sjukdomsprogression tills sjukdomsprogression är bekräftad.
Doseskalering eller -reduktion rekommenderas inte. Behandlingssuppehåll eller utsättning kan krävas baserat på individens säkerhet och tolerans.
Hur används IMFINZI?2
- Behandling måste sättas in och övervakas av en läkare med erfarenhet av cancerbehandling.
- Patienter med lokalt avancerad NSCLC ska utvärderas för behandling baserat på tumöruttryck av PD-L1 som bekräftats med en validerad analysmetod.
- IMFINZI administreras som en intravenös infusion under 1 timme.
- Dosering vid monoterapi, lokalt avancerad NSCLC: 10 mg/kg varannan vecka eller 1 500 mg var fjärde vecka.
- Patienter med en kroppsvikt på 30 kg eller lägre måste få viktbaserad dos, ekvivalent till IMFINZI 10 mg/kg varannan vecka eller 20 mg/kg var fjärde vecka som monoterapi tills vikten ökat till över 30 kg.
- Varaktighet av behandlingen: Fram till sjukdomsprogression, oacceptabel toxicitet eller i högst 12 månader.
- Det rekommenderas att man fortsätter med behandlingen hos kliniskt stabila patienter med begynnande tecken på sjukdomsprogression tills sjukdomsprogression är bekräftad.
- Doseskalering eller -reduktion rekommenderas inte. Behandlingssuppehåll eller utsättning kan krävas baserat på individens säkerhet och tolerans.
För fullständig information se FASS.se IMFINZI