Imfinzi ® (durvalumab)
50 mg/ml, koncentrat till infusionsvätska, lösning, L01FF03, Antineoplastiska medel, monoklonala antikroppar och antikroppsläkemedelskonjugat, PD-1/PDL-1 (Programmerad celldödsprotein 1/dödsligand 1) hämmare, Rx, EF= ingår inte i förmånen.
Indikationer: IMFINZI i kombination med gemcitabin och cisplatin är avsett för första linjens behandling av vuxna med icke-resektabel eller metastaserad gallvägscancer (BTC). IMFINZI som monoterapi och i kombination med tremelimumab är avsett för första linjens behandling av vuxna med avancerad eller icke-resektabelt hepatocellulärt karcinom (HCC).
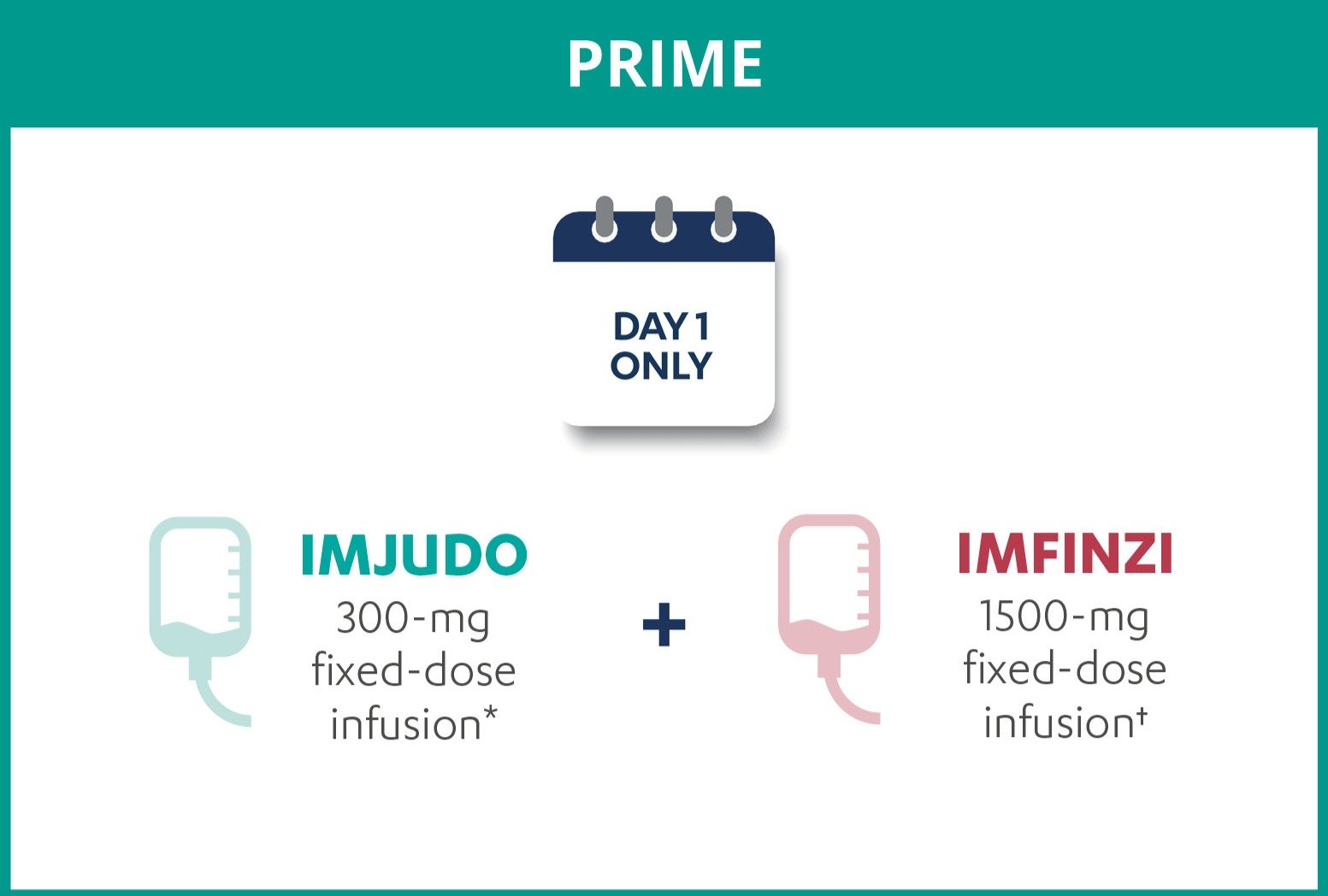
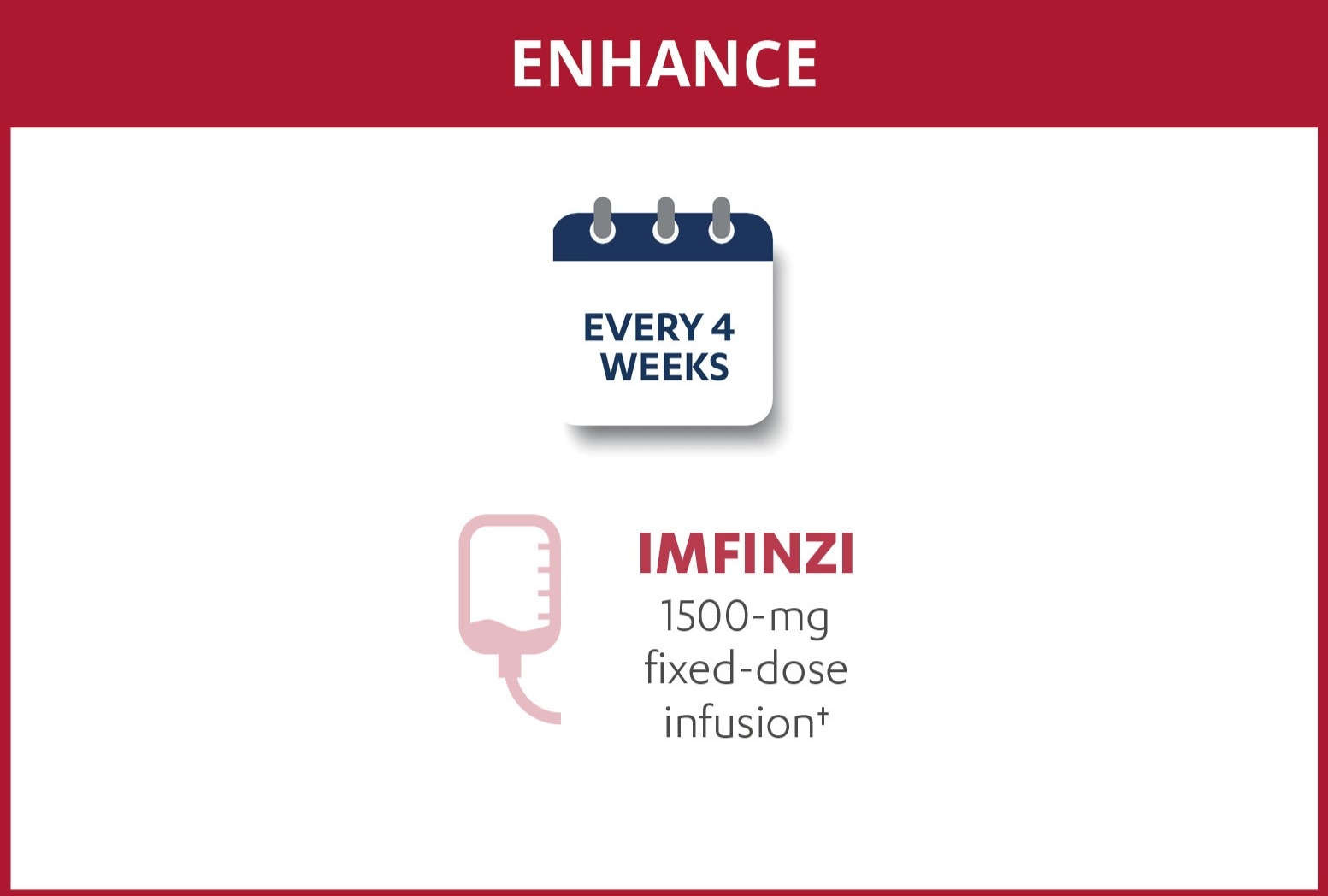
Dosering och administrering: IMFINZI administreras som intravenös infusion under 1 timme. Se produktresumén för information om dosering. Behandling måste sättas in och övervakas av en läkare med erfarenhet av cancerbehandling.
Varningar och försiktighet: Patienter som behandlas med IMFINZI eller IMFINZI i kombination med tremelimumab ska eller bör övervakas avseende tecken och symtom på immunmedierade biverkningar eller symtom på infusionsrelaterade reaktioner. För mer information kring hantering av dessa, se produktresumén. BTC patienter (särskilt patienter med gallstenter) ska övervakas noga för utveckling av kolangit eller gallvägsinfektioner innan behandlingen inleds och regelbundet därefter. För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningsnummer dokumenteras.
Senaste översyn av produktresumén: 2025-03-31. För ytterligare information och priser se www.fass.se
AstraZeneca AB, AstraZeneca Sverige, 151 85 Södertälje, Tel 08-553 260 00. www.astrazeneca.se
SE-19085-04-25-ONC
Imjudo ® (tremelimumab)
▼Detta läkemedel är föremål för utökad övervakning
20 mg/ml, koncentrat till infusionsvätska, lösning, L01FX20, selektiv, human monoklonal IgG2a-antikropp, riktad mot CTLA-4, Rx, EF= ingår inte i förmånen.
Indikationer: IMJUDO i kombination med durvalumab är indicerat för första linjens behandling av vuxna med avancerat eller icke-resektabelt hepatocellulärt karcinom (HCC).
Dosering och administrering: IMJUDO administreras som intravenös infusion under 1 timme. Se produktresumén för information om dosering. Behandling måste sättas in och övervakas av en läkare med erfarenhet av cancerbehandling.
Varningar och försiktighet: Patienter som behandlas med IMJUDO ska eller bör övervakas avseende tecken och symtom på immunmedierade biverkningar eller symtom på infusionsrelaterade reaktioner. För mer information kring hantering av dessa, se produktresumén. För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningsnummer dokumenteras.
Senaste översyn av produktresumén: 2025-02-14. För ytterligare information och priser se www.fass.se
AstraZeneca AB, AstraZeneca Sverige, 151 85 Södertälje, Tel 08-553 260 00. https://www.astrazeneca.se/
SE-18686-02-25-ONC