Lynparza® (olaparib) – >1 year OS difference compared with placebo in PSR gBRCAm ovarian cancer1
Recurrent ovarian cancer is typically incurable. Patients with platinum sensitive relapse have a median overall survival of 2.5–3 years and progression-free survival of 8-13 months from the start of second line chemotherapy.1 Lynparza is a PARPi with long history, being in clinical use since 2014.2 In addition to clinical experience, its safety and efficacy data has been collected with long-term follow-up in clinical studies.3,4
In the phase II Study 19 (https://pubmed.ncbi.nlm.nih.gov/30353045/), with a median follow-up of 78.0 months, 10% of patients experienced a durable benefit from Lynparza maintenance monotherapy for over 6 years consistently across BRCAm and BRCAwt subgroups. The majority of patients receiving Lynparza long term were on full dose immediately prior to the end of treatment. This suggests enduring dose modifications are not required to maintain long term tolerability.3
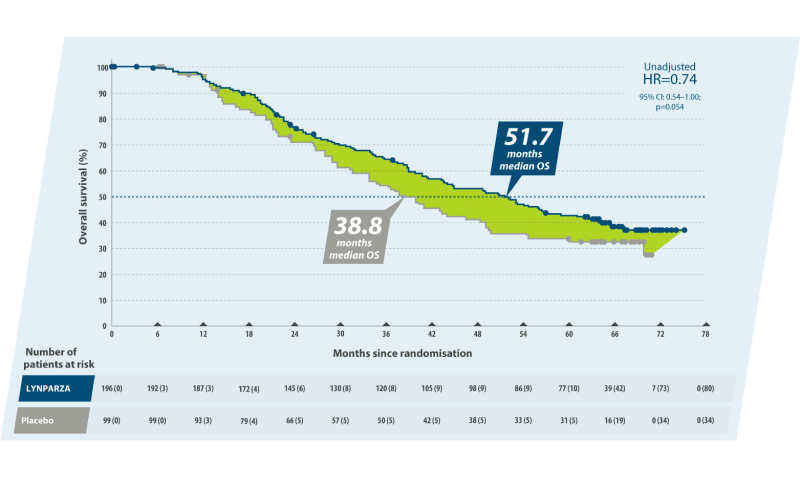
>1 year difference in median OS with Lynparza compared to placebo
Overall survival is the gold standard efficacy endpoint in ovarian cancer trials. However, improvements in overall survival are difficult to demonstrate. This is because of crossover from the control group to the investigational group and longer post-progression survival associated with post-progression therapies.1
The phase III SOLO2 study (https://pubmed.ncbi.nlm.nih.gov/28754483/) investigated the efficacy of maintenance therapy Lynparza compared with placebo in patients (n=295) with platinum-sensitive relapsed ovarian cancer and BRCA1/2 mutation. The final analysis of the trial showed a clinically meaningful, although not statistically significant difference in overall survival (51.7 months in Lynparza group compared with 38.8 months in placebo group, HR 0.74, 95% CI 0.54‒1.00; p = 0.054). Although 38% of patients had received subsequent PARPi treatment, there was a 12.9 months difference between the treatment arms.1