LYNPARZA (olaparib) is a PARP inhibitor, which provokes tumor cell death by inducing DNA double-strand breaks in the cells with homologous recombination deficiency caused e.g., by deleterious mutations in BRCA1 or BRCA2 genes1,2

OlympiA
LYNPARZA (olaparib) demonstrated prolonged invasive disease-free survival and overall survival in patients with gBRCA1- or gBRCA2-mutated early breast cancer1-3
OlympiA study investigated LYNPARZA in BRCA-mutated HER2-negative early breast cancer
- The phase III OlympiA study investigated the efficacy of LYNPARZA versus placebo as adjuvant therapy in high-risk early breast cancer.
- A total of 1,836 patients with BRCA1/2-mutated HER2-negative early breast cancer and high-risk clinical features were included in the study.1,2 The patients had received prior local treatment and neoadjuvant or adjuvant chemotherapy.
- The patients were randomized 1:1 for 1 year of treatment with oral LYNPARZA (300 mg twice daily) or placebo.1,2
- The primary end-point was invasive disease-free survival and secondary endpoints included distant disease-free survival and overall survival.1,2
OlympiA demonstrated significantly improved survival outcomes in patients treated with LYNPARZA versus placebo
- In the OlympiA study, adjuvant LYNPARZA reduced the risk of invasive disease recurrence by 42% (HR 0.58; 99.5% CI, 0.41 to 0.82; P=0.0000073; 9% difference LYNPARZA 86% vs. placebo 77%).1
-
A descriptive analysis showed that the IDFS benefit was sustained with ~1 year of additional median follow up (HR 0.63; 95% Cl, 0.50-0.78;7.3% difference LYNPARZA 82.7% vs. placebo 75.4%).3
- In the second pre-specified interim analysis, LYNPARZA was also shown to significantly improve the overall survival by reducing the risk of death by 32% (HR 0.68; 98.5% CI, 0.47–0.97; P=0.0091; 4% difference LYNPARZA 90% vs 86% vs. placebo) with a median follow-up of 3.5 years (Order a reprint of the original research here).1
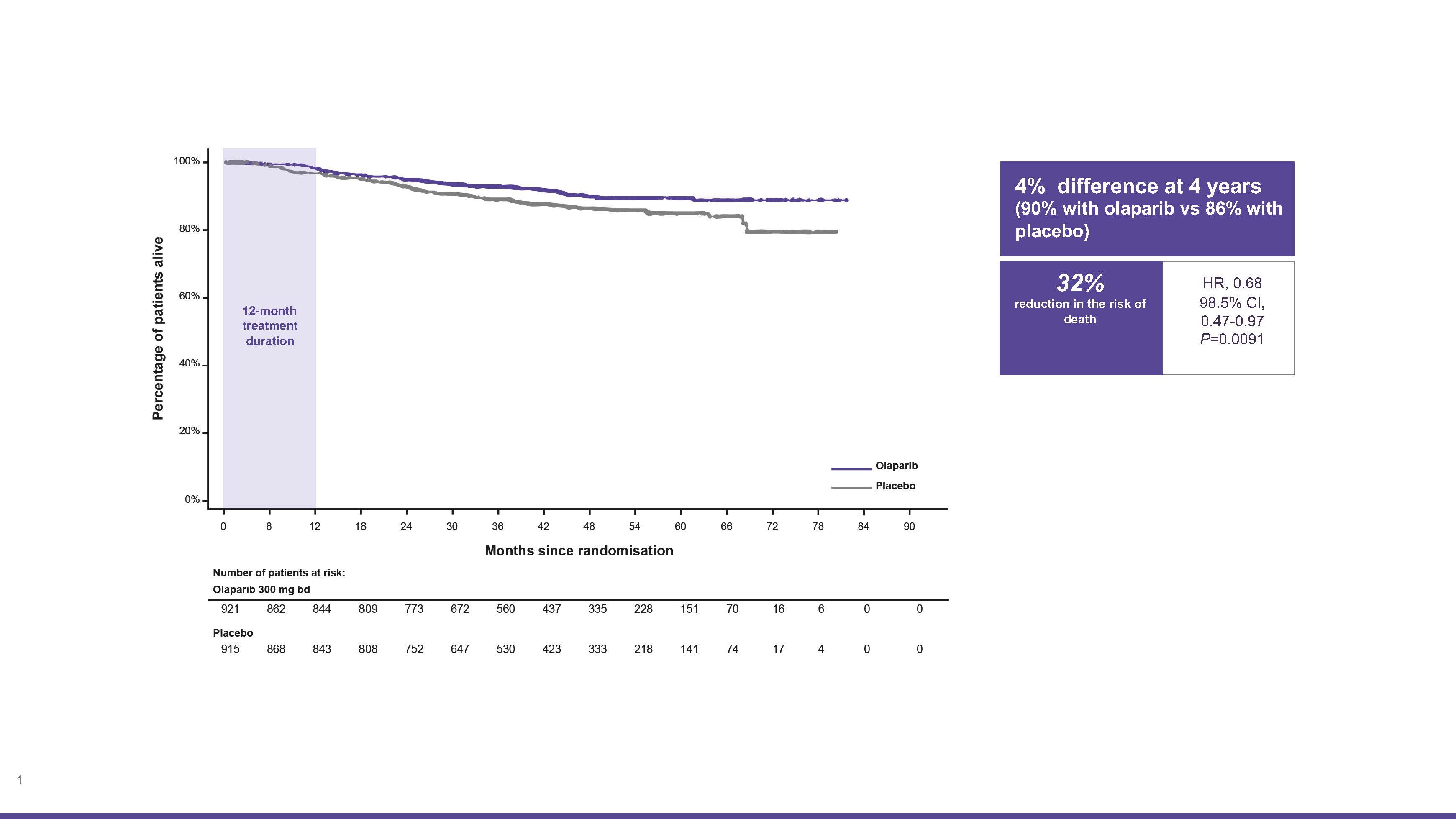
Kaplan-Meier estimate of overall survival (OS). The P value threshold for significance in this prespecified event-driven interim analysis was 0.015 (adapted from Geyer et al. 2022).
Adverse events associated with LYNPARZA
- The adverse events associated with LYNPARZA in clinical trials are generally of mild or moderate severity (grade 1 or 2) and do not generally require treatment discontinuation.1
- The most frequent adverse reactions in patients (≥ 10%) on LYNPARZA monotherapy include nausea, fatigue, anemia, vomiting, diarrhea, decreased appetite, headache, neutropenia, dysgeusia, cough, leukopenia, dizziness, dyspnea and dyspepsia.1
Important safety information1
- CONTRAINDICATIONS: Breast‑feeding during treatment and for 1 month after the last dose (see section 4.6).
- SPECIAL WARNINGS AND PRECAUTIONS FOR USE: Haematological toxicity: Baseline testing, followed by monthly monitoring, of complete blood counts is recommended for the first 12 months of treatment and periodically after this time to monitor for clinically significant changes in any parameter during treatment. Myelodysplastic syndrome/Acute myeloid leukaemia: If patient is diagnosed with MDS/AML is confirmed during Lynparza treatment, Lynparza should be discontinued and the patient treated appropriately. Venous Thromboembolic Events: Monitor patients for clinical signs and symptoms of venous thrombosis and pulmonary embolism and treat as medically appropriate. Pneumonitis: If patients present with new or worsening respiratory symptoms such as dyspnoea, cough and fever, or an abnormal chest radiologic finding is observed, Lynparza treatment should be interrupted and prompt investigation initiated. Hepatotoxicity: If clinical symptoms or signs suggestive of hepatotoxicity develop, prompt clinical evaluation of the patient and measurement of liver function tests should be performed. In case of suspected drug-induced liver injury (DILI), treatment should be interrupted.
- IMPORTANT INTERACTIONS: Lynparza co administration with strong or moderate CYP3A inhibitors is not recommended. If a strong or moderate CYP3A inhibitor must be co administered, the dose of Lynparza should be reduced (see sections 4.2 and 4.5 in SPC). See section 4.5 in SPC for more information on other types of interactions.
Choose treatment based on gBRCA testing
- The OlympiA study demonstrated that adjuvant LYNPARZA improves survival outcomes in HER-negative high-risk early gBRCA-mutated breast cancer.1-3
- Approximately 5% of all breast cancer patients carry pathogenic or likely pathogenic germline BRCA1 or BRCA2 mutation.2
- Test patients for BRCA mutations at diagnosis to identify those who may benefit from treatment with adjuvant LYNPARZA.1
Video
Watch the video describing the OlympiA study.

References
-
Lynparza summary of product characteristics (Mar 30, 2023)
-
Tutt ANJ, et al. N Engl J Med. 2021 Jun 24;384(25):2394-2405.
-
Geyer Jr CE, et al. Ann Oncol. 2022 Oct 10;S0923-7534(22)04165-5.
LYNPARZA®(olaparib) VIKTIG INFORMASJON
Full indikasjonstekst finner du i Felleskatalogen.
Brystkreft: Monoterapi eller i kombinasjon med endokrin behandling til adjuvant behandling av voksne pasienter med kimbane BRCA1/2-mutasjoner som har HER2-negativ tidlig brystkreft med høy risiko for tilbakefall, og som tidligere har blitt behandlet med neoadjuvant elleradjuvant kjemoterapi (se pkt. 4.2 og 5.1 i SPC).
DOSERING OG ADMINISTRASJONSMÅTE
Anbefalt dose av Lynparza som monoterapi eller i kombinasjon med endokrin behandling er 300 mg (to tabletter à 150 mg) som skal tas to ganger daglig, tilsvarende en daglig dose på totalt 600 mg. Tablett à 100 mg er tilgjengelig for dosereduksjon. Ved bruk av Lynparza i kombinasjon med endokrin behandling, se den fullstendige produktinformasjonen for legemidler som brukes til endokrin behandling i kombinasjon med Lynparza (aromatasehemmer/antiøstrogen), for informasjon om anbefalt dosering.
PRIS, REFUSJON OG FORSKRIVNINGSREGLER
Pakninger og priser: Tabletter: 100 mg: 56 stk. kr 27754,60. 150 mg: 56 stk. kr 27754,60. Reseptgruppe C. H-resept.
Beslutning i Beslutningsforum for nye metoder (28.08.2023): Olaparib (Lynparza) kan innføres som monoterapi eller i kombinasjon med endokrin behandling til adjuvant behandling av voksne pasienter med kimbane BRCA1/2-mutasjoner som har HER2-negativ tidlig brystkreft med høy risiko for tilbakefall, og som tidligere har blitt behandlet med neoadjuvant eller adjuvant kjemoterapi.
Lynparza inngår i de regionale helseforetakenes anbefalinger for onkologiske legemidler, og rekvirering skal gjøres i tråd med disse: https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi/
Markedsføringsinnehaver: AstraZeneca AS, Karvesvingen 7, 0579 Oslo, tel. 21006400
NO-13177-10-24-ONC
Før forskrivning av LYNPARZA, se FK-tekst eller SPC på www.felleskatalogen.no
-
Ta del i vår digitale kommunikasjon?
Vi merker oss at flere tenker som vi og ønsker å få kommunikasjon digitalt. Som et ledd i vår digitaliserings- og bærekraft prosess reduserer vi på AstraZeneca mengden av papir som vi sender ut med posten. Registrer deg allerede i dag for og ikke gå glipp av våre medisinske nyheter, det seneste om våre produkter, informasjon om kurs og utdanning, pasientstøtte, stipender og annen relevant informasjon som kan gjøre ditt daglige arbeid enklere. Gjør som mange av dine kolleger og ta del i informasjon når det passer deg.
Registrer deg på AstraZeneca Connect
Når du registrerer deg, får du ekstra funksjonalitet i form av at tidligere ordrer lagres og kan gjenbrukes ved ny bestilling. Dine opplysninger fylles også automatisk ut, noe som forenkler prosessen ved gjentatte bestillinger samt ved øvrig kontakt med AstraZeneca.

