Which patients can benefit from treatment with LYNPARZA?1
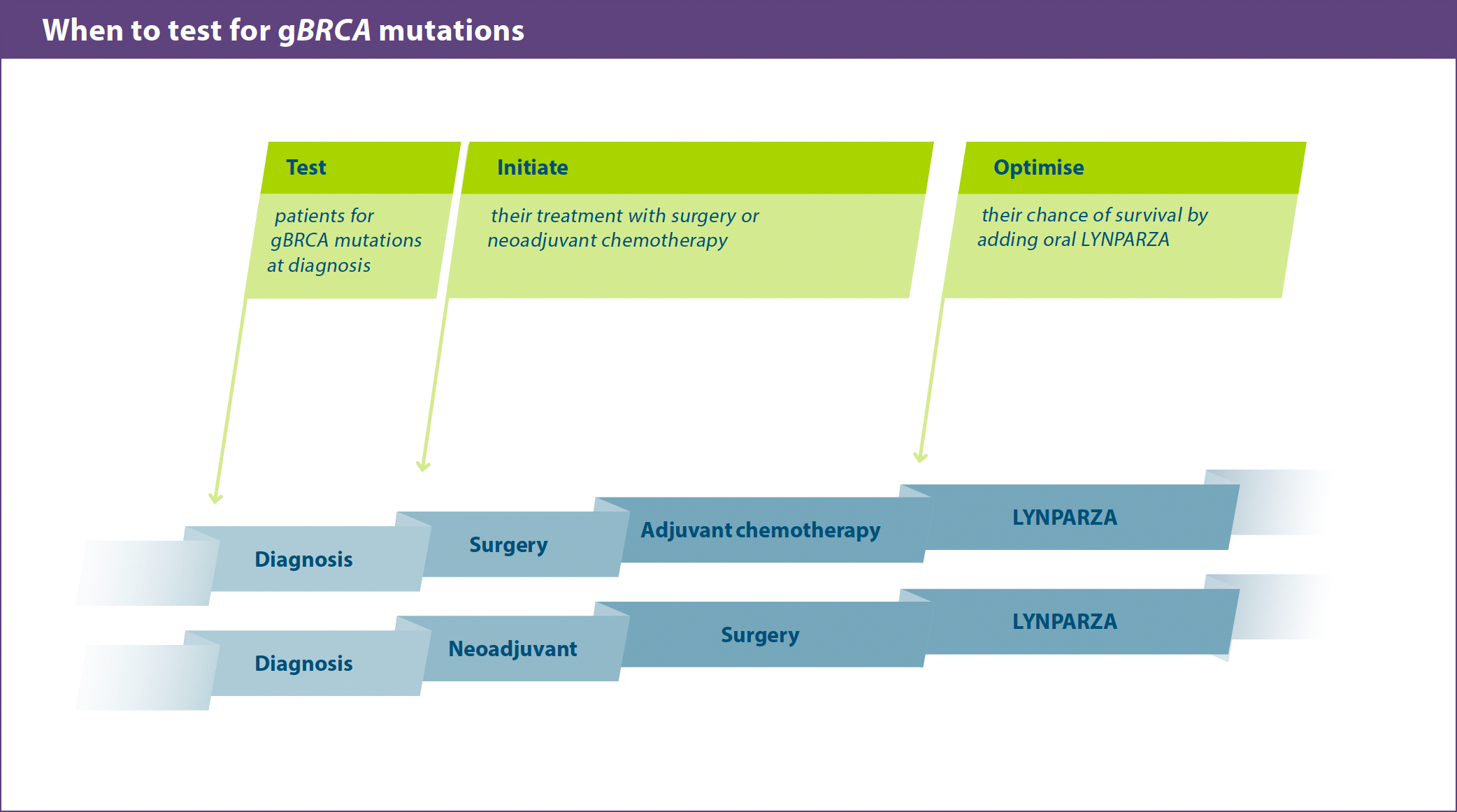
LYNPARZA is indicated for the adjuvant treatment of patients with germline BRCA1/2 mutations, who have HER2-negative, high-risk early breast cancer previously treated with neoadjuvant or adjuvant chemotherapy. Patients must have tested positive for deleterious or suspected deleterious, germline BRCA1/2 mutation before LYNPARZA treatment initiation.
Lynparza is also indicated for metastatic gBRCA1/2m breast cancer, more information can be found in Felleskatalogen.
LYNPARZA treatment — Dosing and treatment duration1
- LYNPARZA is an oral, chemotherapy-free treatment that patients can take at home.
- LYNPARZA tablets can be used as monotherapy or in combination with endocrine therapy.
- The recommended dose of LYNPARZA as monotherapy or in combination with endocrine therapy is 300 mg (two 150 mg tablets) taken twice daily, with or without food.
- Patients can be treated with LYNPARZA for up to 1 year, or until disease recurrence or unacceptable toxicity if that occurs first.








