VIKTIG INFORMASJON - IMFINZI®(durvalumab)
Durvalumab binder programmert celledød-ligand-1 (PD-L1) og blokkerer interaksjonen mellom PD- L1 og reseptorene for programmert celledød-1 (PD-1) og B7-1. Blokkerer selektivt interaksjonen mellom PD-L1 og PD-1 og B7-1. Selektiv blokkering forsterker immunsystemets antitumorrespons og øker T-celleaktivering. Induserer ikke antistoffavhengig cellemediert cytotoksisitet (ADCC).
INDIKASJON
Ikke-småcellet lungekreft (NSCLC)
IMFINZI i kombinasjon med platinabasert kjemoterapi som neoadjuvant behandling, etterfulgt av IMFINZI som monoterapi som adjuvant behandling, er indisert til behandling av voksne med resekterbar NSCLC med høy risiko for tilbakefall og ingen EGFR-mutasjoner eller ALK-rearrangering
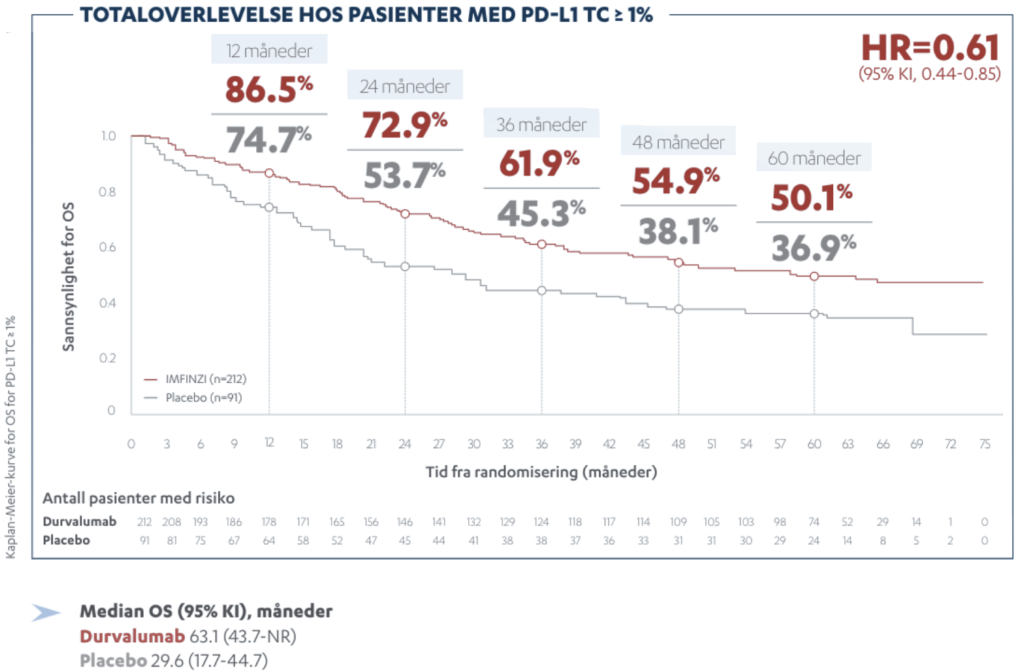
IMFINZI er indisert som monoterapi til behandling av lokalavansert, inoperabel, ikke-småcellet lungekreft (NSCLC) hos voksne hvor tumor uttrykker PD-L1 på ≥ 1 % av tumorcellene, og med sykdom som ikke har progrediert etter platinabasert kjemoradiasjon.
IMFINZI i kombinasjon med tremelimumab og platinabasert kjemoterapi er indisert som førstelinjebehandling hos voksne med metastatisk NSCLC uten sensibiliserende EGFR-mutasjoner eller ALK-positive mutasjoner.
Småcellet lungekreft (SCLC)
IMFINZI som monoterapi er indisert til behandling av begrenset småcellet lungekreft (LS-SCLC) hos voksne med sykdom som ikke har progrediert etter platinabasert kjemoradiasjon.
IMFINZI i kombinasjon med etoposid og enten karboplatin eller cisplatin er indisert som førstelinjebehandling hos voksne med utbredt småcellet lungekreft (ES-SCLC).
Full indikasjonstekst finner du på www.felleskatalogen.no
DOSERING OG ADMINISTRASJONSMÅTE
Behandlingen må startes opp og overvåkes av en lege med erfaring i kreftbehandling.
Pasienter med lokalavansert NSCLC bør evalueres for behandling basert på tumorekspresjon av PD- L1 bekreftet med en validert test.
IMFINZI administres som en intravenøs infusjon i løpet av 1 time.
Dosering:
Pasienter med en kroppsvekt på 30 kg eller lavere må få vektbasert dosering, se fullstendig preparatomtale.
Resekterbar NSCLC: 1500 mg i kombinasjon med platinabasert kjemoterapi hver 3. uke i opptil 4 sykluser før operasjon etterfulgt av 1500 mg som monoterapi hver 4. uke i opptil 12 sykluser etter operasjon. Behandlingsvarighet: Neoadjuvant fase: inntil sykdomsprogresjon som utelukker definitiv operasjon, eller uakseptabel toksisitet. Adjuvant fase: inntil tilbakefall, uakseptabel toksisitet, eller maksimalt 12 sykluser etter operasjon.
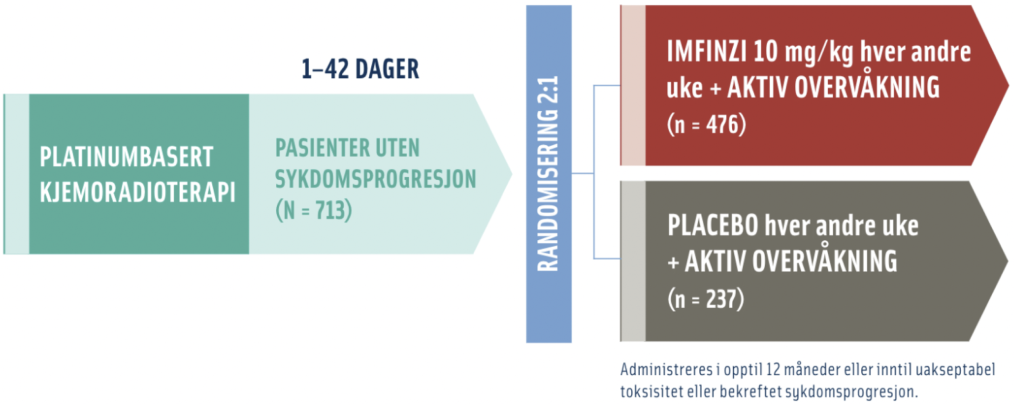
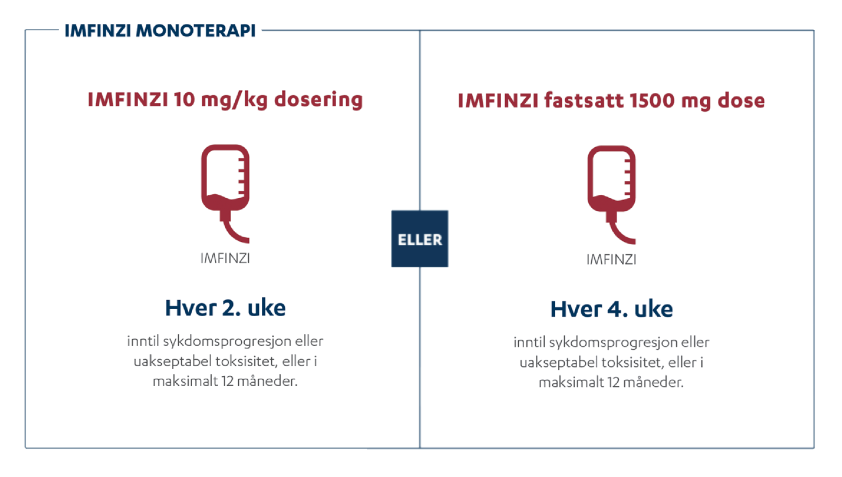
Lokalavansert NSCLC: 10 mg/kg annenhver uke eller 1500 mg hver 4. uke. Behandlingsvarighet: Inntil sykdomsprogresjon, uakseptabel toksisitet eller i maksimalt 12 måneder.
Metastatisk NSCLC: Under platina-kjemoterapi: 1 500 mg i kombinasjon med tremelimumab 75 mg og platinabasert kjemoterapi hver 3. uke (21 dager) i 4 sykluser (12 uker). Etter platina-kjemoterapi: 1 500 mg hver 4. uke som monoterapi og histologibasert pemetrexed vedlikeholdsbehandlingd hver 4. uke. En femte dose tremelimumab 75 mg,f bør gis i uke 16 samtidig med IMFINZI. Behandlingsvarighet: Inntil sykdomsprogesjon eller uakseptabel toksisitet.
LS-SCLC: 1500 mg hver 4 uke. Behandlingsvarighet: Inntil sykdomsprogresjon, uakseptabel toksisitet eller i maksimalt 24 måneder.
ES -SCLC: 1 500 mg i kombinasjon med kjemoterapi hver 3. uke (21 dager) i 4 sykluser, etterfulgt av 1 500 mg hver 4. uke som monoterapi. Behandlingsvarighet: Inntil sykdomsprogresjon eller uakseptabel toksisitet.
UTVALGT SIKKERHETSINFORMASJON
Forsiktighetsregler
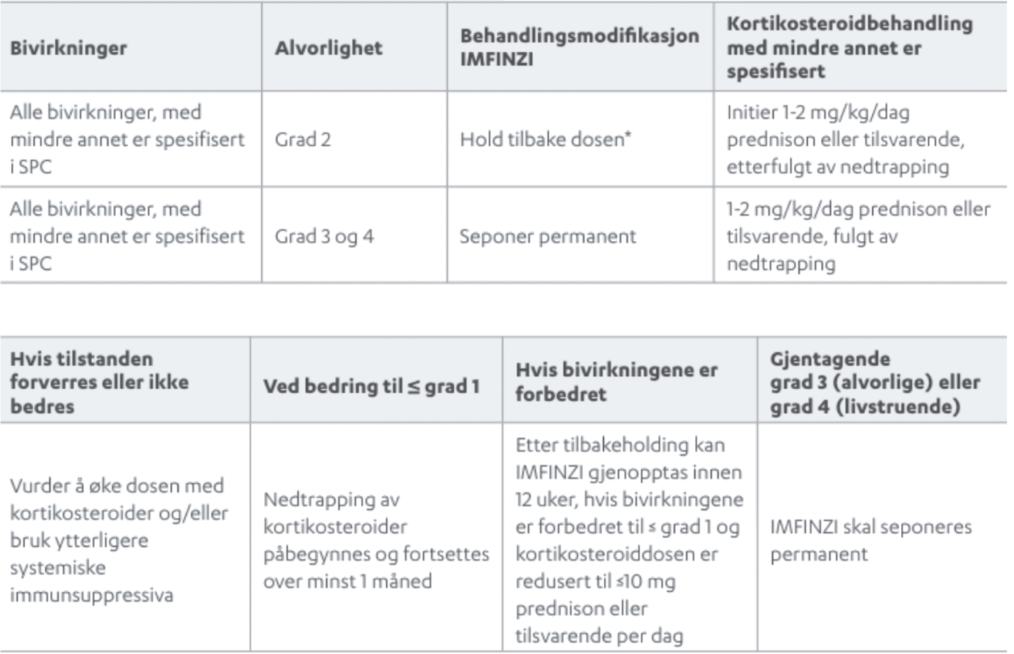
Ved mistanke om immunmedierte bivirkninger, bør det utføres tilstrekkelig evaluering for å bekrefte etiologien. Retningslinjer for håndtering av immunmedierte bivirkninger er beskrevet i preparatomtalen.
Stråleindusert pneumonitt er ofte sett ved stråleterapi mot lungene, og pasienten bør overvåkes for tegn på pneumonitt eller stråleindusert pneumonitt.
Bivirkninger
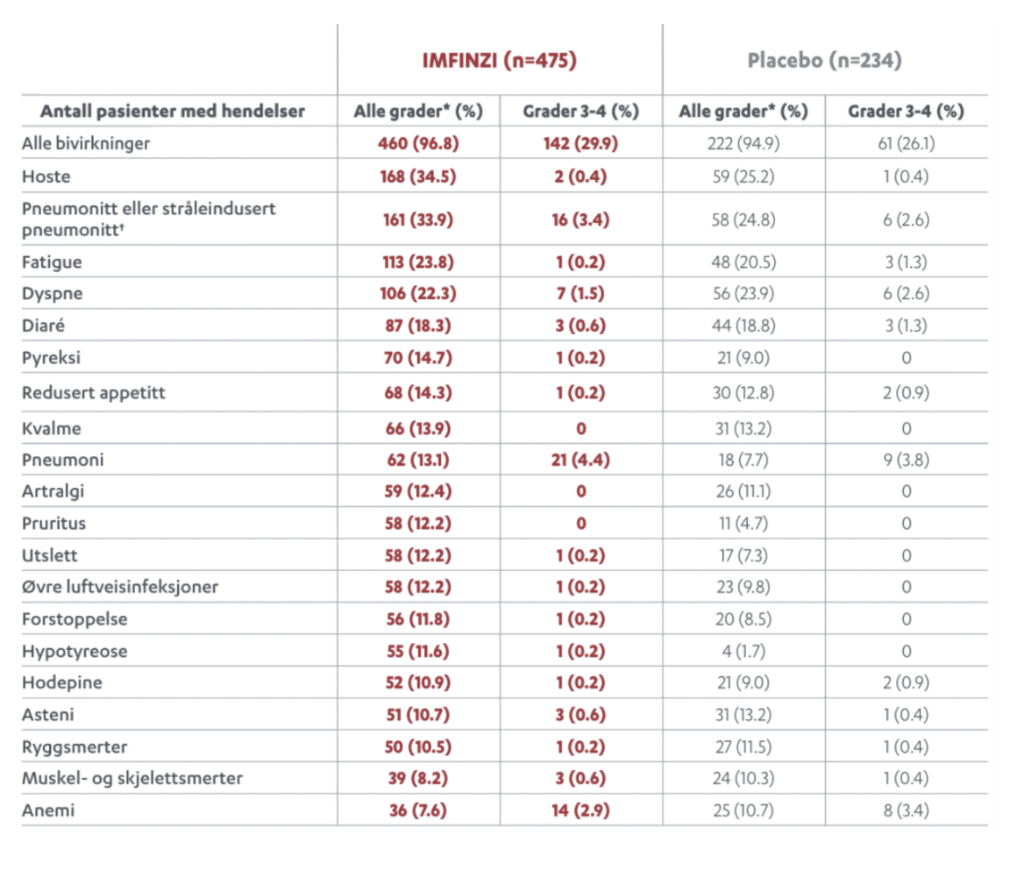
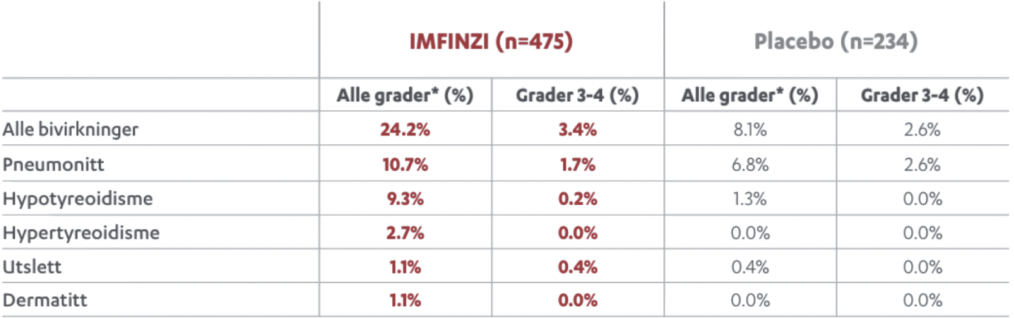
De vanligste bivirkningene var hoste/produktiv hoste, diaré, utslett, artralgi, pyreksi, øvre luftveisinfeksjoner, abdominalsmerter, pruritus og hypotyreose.
Immunmedierte bivirkninger
Følgende immunmedierte bivirkninger har blitt observert hos pasienter som har blitt behandlet med IMFINZI: Pneumonitt, hepatitt, kolitt, hypotyreose, hyperthyreose, tyreoiditt, binyrebarksvikt, diabetes mellitus type 1, hypofysitt/hypopituitarisme, nefritt, utslett eller dermatitt, myokarditt, myasthenia gravis, transvers myelitt, myositt, polymyositt, meningitt, encefalitt, Guillain-Barrés syndrom, immunologisk trombocytopeni, immunmediert artritt, uveitt og ikke-infeksiøs cystitt.
Graviditet, amming og fertilitet: Durvalumab anbefales ikke under graviditet og til fertile kvinner som ikke bruker sikker prevensjon under og i minst 3 måneder etter behandling. Risiko for diende barn kan ikke utelukkes.
PRIS, REFUSJON OG FORSKRIVNINGSREGLER
Pakninger og priser (AUP) Konsentrat til infusjonsvæske. Hetteglass: 2,4 ml (120 mg): kr 8269,90. 10 ml (500 mg): kr 33794,30
Reseptgruppe C.
Markedsføringsinnehaver: AstraZeneca AS, Karvesvingen 7, 0579 Oslo, tel. 21006400
NO-13988 - 04-25 -ONC
Før forskrivning av IMFINZI, se FK-tekst eller SPC på www.felleskatalogen.no