
PAOLA-1
LYNPARZA (olaparib) in combination with bevacizumab for HRD-positive patients with advanced ovarian cancer. 1
PAOLA-1 study
Katharina Bischof, MD, PhD Senior Consultant at Radiumhospitalet, Oslo University Hospital, talks about the PAOLA-1 study and the Norwegian recommendations for primary maintenance treatment for advanced high-grade serous ovarian cancer.
LYNPARZA + bevacizumab for HRD-positive patients with advanced ovarian cancer2
PAOLA-1 was a randomized, double-blind, phase III trial conducted in 11 countries. It evaluated maintenance therapy with Lynparza + bevacizumab, compared with placebo + bevacizumab, in patients with newly diagnosed advanced ovarian cancer, irrespective of biomarker or surgical status, who were in clinical response after first-line platinum-based chemotherapy plus bevacizumab.2
Why combine LYNPARZA with bevacizumab?
Multiple cell populations exist in the same tumor already at diagnosis, and it has strong clinical implications. Consequently, single targeted agents may not effectively kill all tumor cells and different targeted agents need to be combined to collectively act through inhibition of distinct pathways.3
PARP inhibitors, such as LYNPARZA, provoke tumor cell death by inducing DNA double-strand breaks in the cells with homologous recombination deficiency (HRD; read more about HRD as a biomarker here).4 VEGF inhibitors such as bevacizumab, inhibit angiogenesis and thus tumor growth through the inhibition of the VEGF pathway.3 Preclinical studies have shown synergistic effects of PARP inhibitors and anti-angiogenic agents (e.g. bevacizumab). PARP inhibition is also shown to reduce VEGF expression and anti-angiogenic agents induce HRD. Therefore, the premise of combining LYNPARZA and bevacizumab is based on the rationale that direct targeting of PARP by LYNPARZA and indirect inhibition of homologous recombination by bevacizumab will be therapeutically beneficial compared to LYNPARZA or bevacizumab alone.4
Click to watch a short video where SOLO-1 and PAOLA-1 study being explained in 3 minutes.
LYNPARZA+bevacizumab provides long-term data on both PFS and OS for HRD-positive patients1,5
A statistically significant progression-free survival (PFS) benefit was demonstrated in the intention-to-treat (ITT) population with addition of Lynparza to bevacizumab vs placebo+bevacizumab. 2
Effect on OS and PFS were investigated in prespecified exploratory subgroup analyses in patients with BRCA1 and/or BRCA2 mutations and in those who tested positive for homologous recombination deficiency (HRD defined as a tumor BRCAm and/or genomic instability). The data showed a numerical improvement of OS and PFS with Lynparza+bevacizumab vs placebo+bevacizumab.1,5
PAOLA-1 study assessed LYNPARZA + bevacizumab efficacy in 1L maintenance setting using an active comparator arm 2
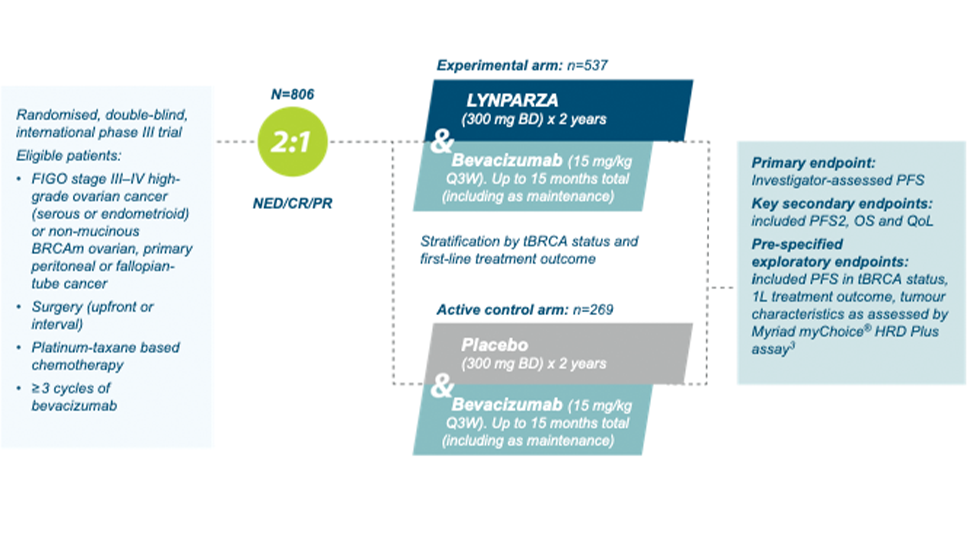
Figure created by AZ based on Ray-Coquard et al. (2019)2
PAOLA-1. 5 year pre-specified exploratory subgroup analysis:
PFS in HRD-positive patients5
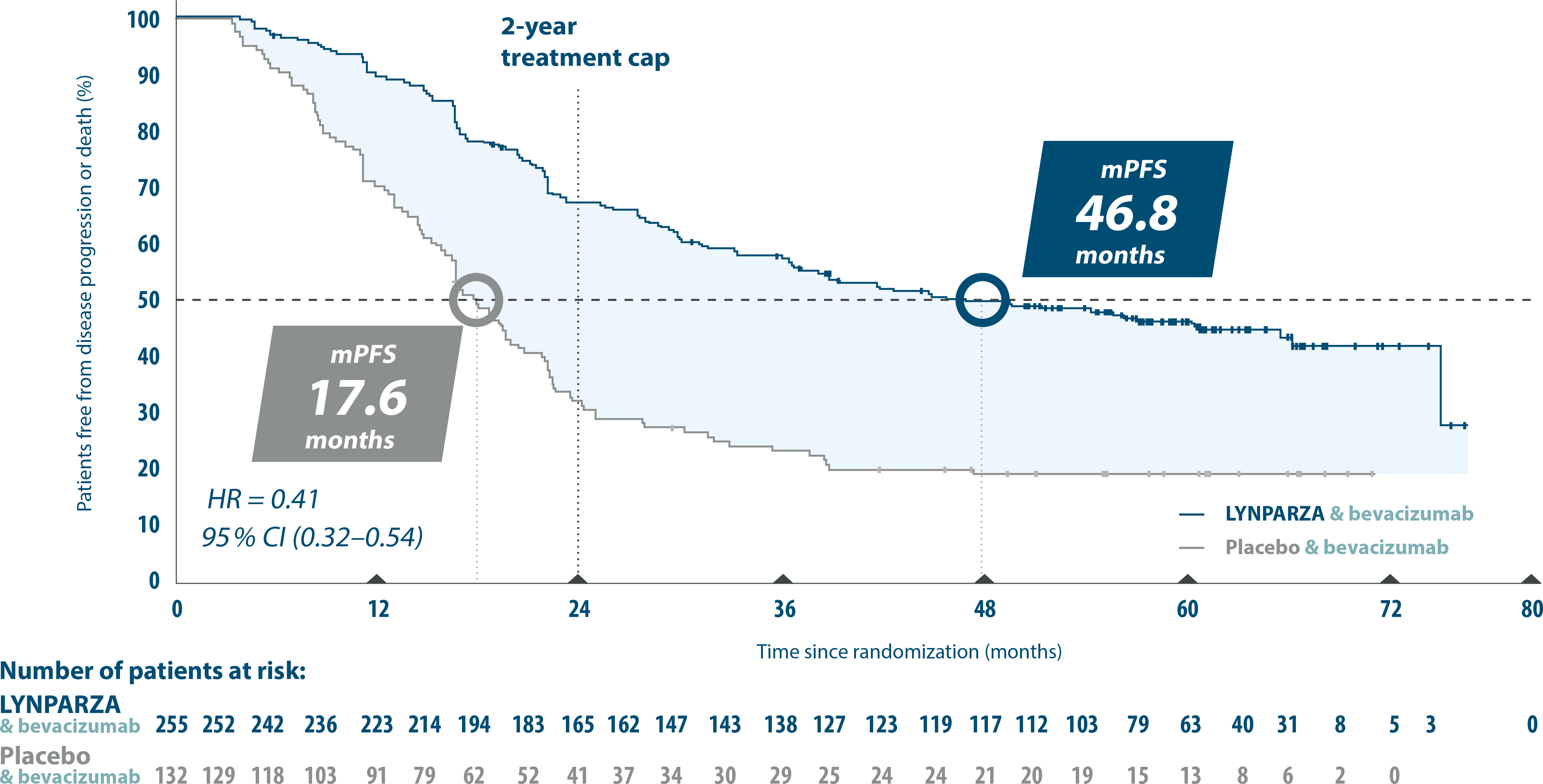
Adapted from Ray-Conquard, et al. 20235
Almost 4 years mPFS for patients treated with LYNPARZA+bevacizumab vs bevacizumab+pacebo (46.8 vs 17.6 months with placebo+bevacizumab. (HR 0.41, 95% Cl 0.32-0.54)5
PAOLA-1. 5 year pre-specified exploratory subgroup analysis:
Final OS in HRD-positive patients1,5
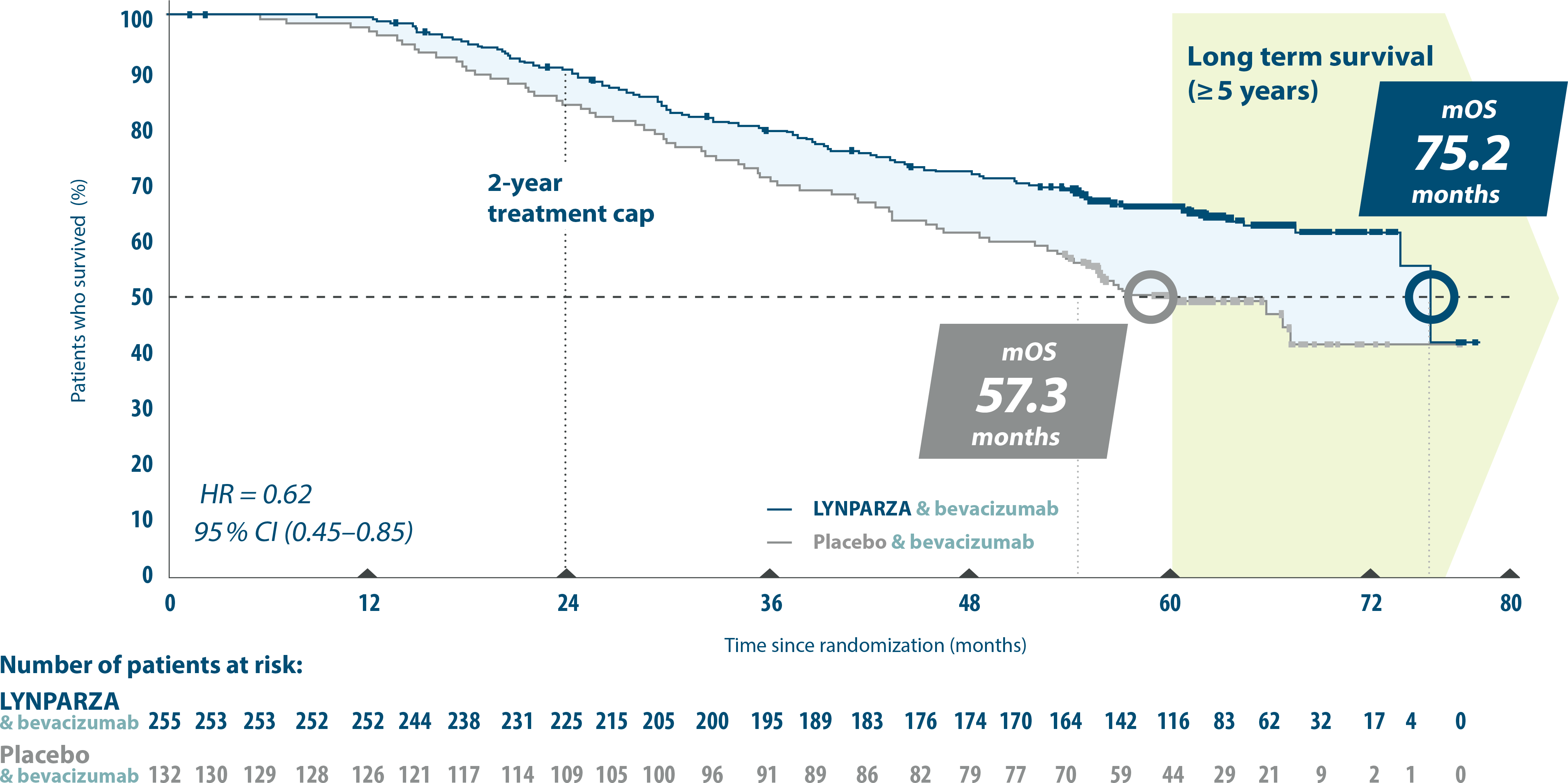
Adapted from Ray-Coquard, et al. 20235
6 years mOS at 5 years with LYNPARZA & bevacizumab vs placebo & bevacizumanb (HR=0.62. 95% Cl 0.45-0.85).1,5
Patients receiving a PARPi during any subsequent treatment: LYNPARZA + bevacizumab 17.3 % vs placebo+ bevacizumab 50.8%.5
Read the whole publication now at sciencedirect.com
Assessing the impact of clinical risk on outcomes with LYNPARZA & bevacizumab8
All patients with advanced ovarian cancer are at high risk of disease progression6
- However, it is well known that disease stage and surgical outcome impact the risk of relapse and survival.7
- Even ”low-risk” group has a high risk of progression6
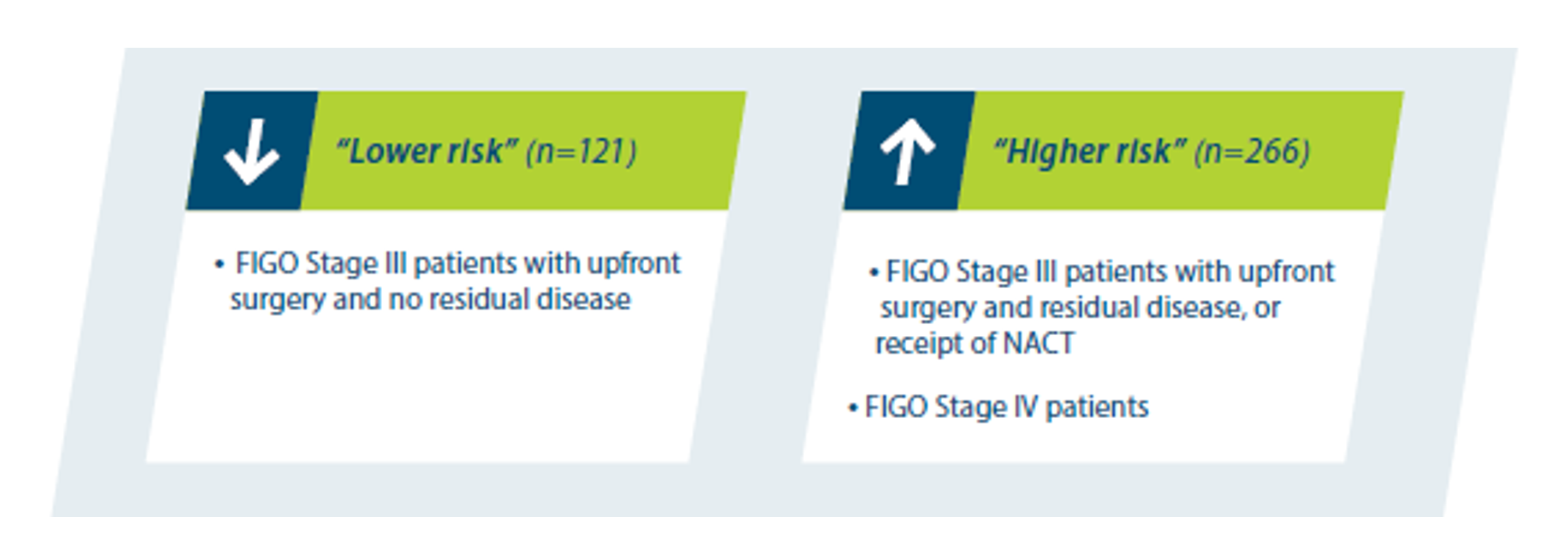
- Exploratory post-hoc analyses were performed to answer the question of how these factors may affect outcomes with LYNPARZA + bevacizumab.8
- The first analyzed PFS using data from the PAOLA-1 2-year primary analysis, and the second analyzed OS using data from the PAOLA-1 5-year OS analysis.8
LYNPARZA & bevacizumab improves both PFS and OS9
~1 of 2 patients were still alive at 5 years in ”higher risk” group9
5 year pre-specified exploratory subgroup analysis: HRD-positive patients ”higher risk*”
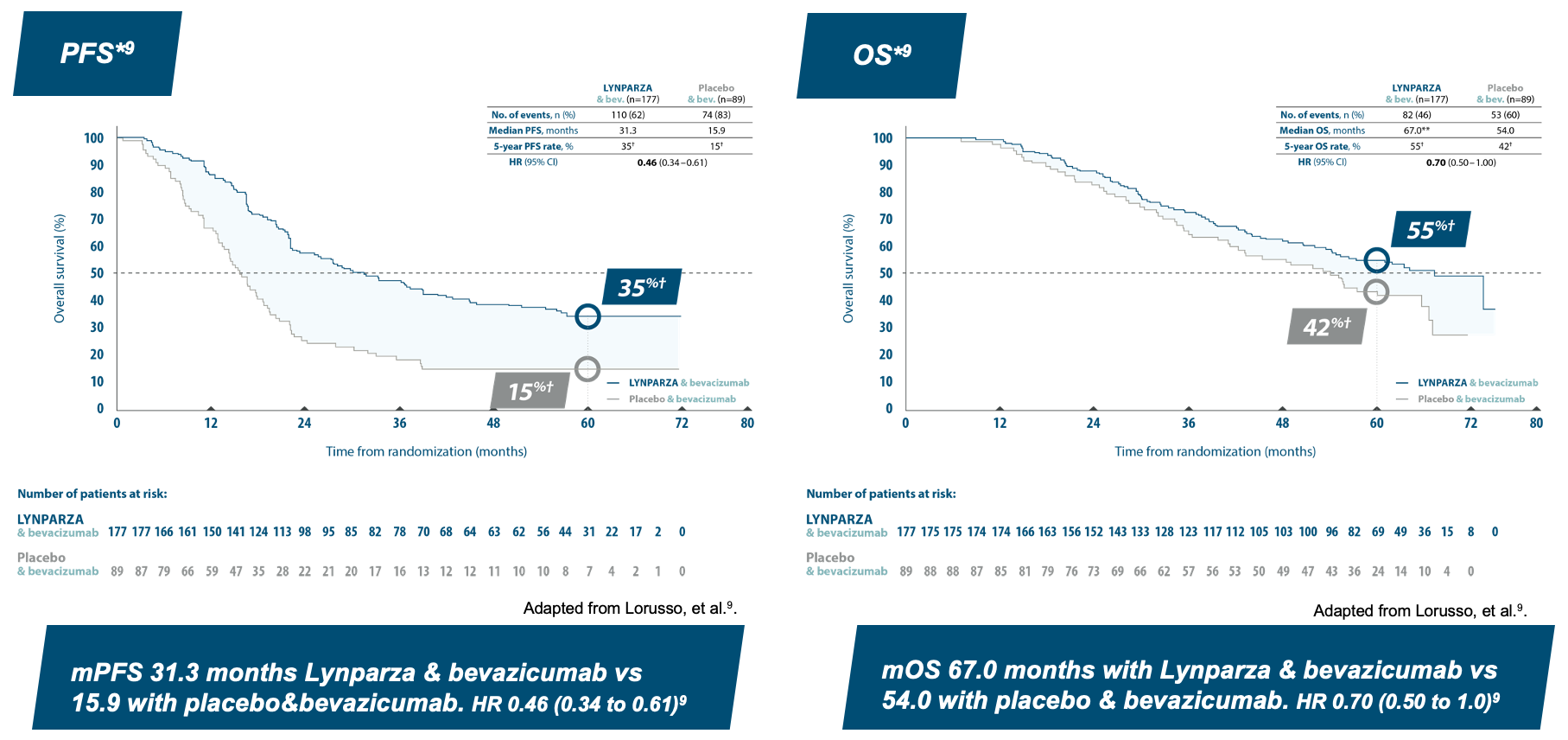
*Higher risk defined as: FIGO Stage III patients with upfront surgery and residual disease or NACT, FIGO Stage IV patients. **Unstable median due to lack of events. †Kaplan-Meier estimates.
LYNPARZA & bevacizumab improves both PFS and OS9
Almost 9 of 10 patients still alive at 5 years in ”lower risk” group9
5 year pre-specified exploratory subgroup analysis: HRD-positive patients ”lower risk*”
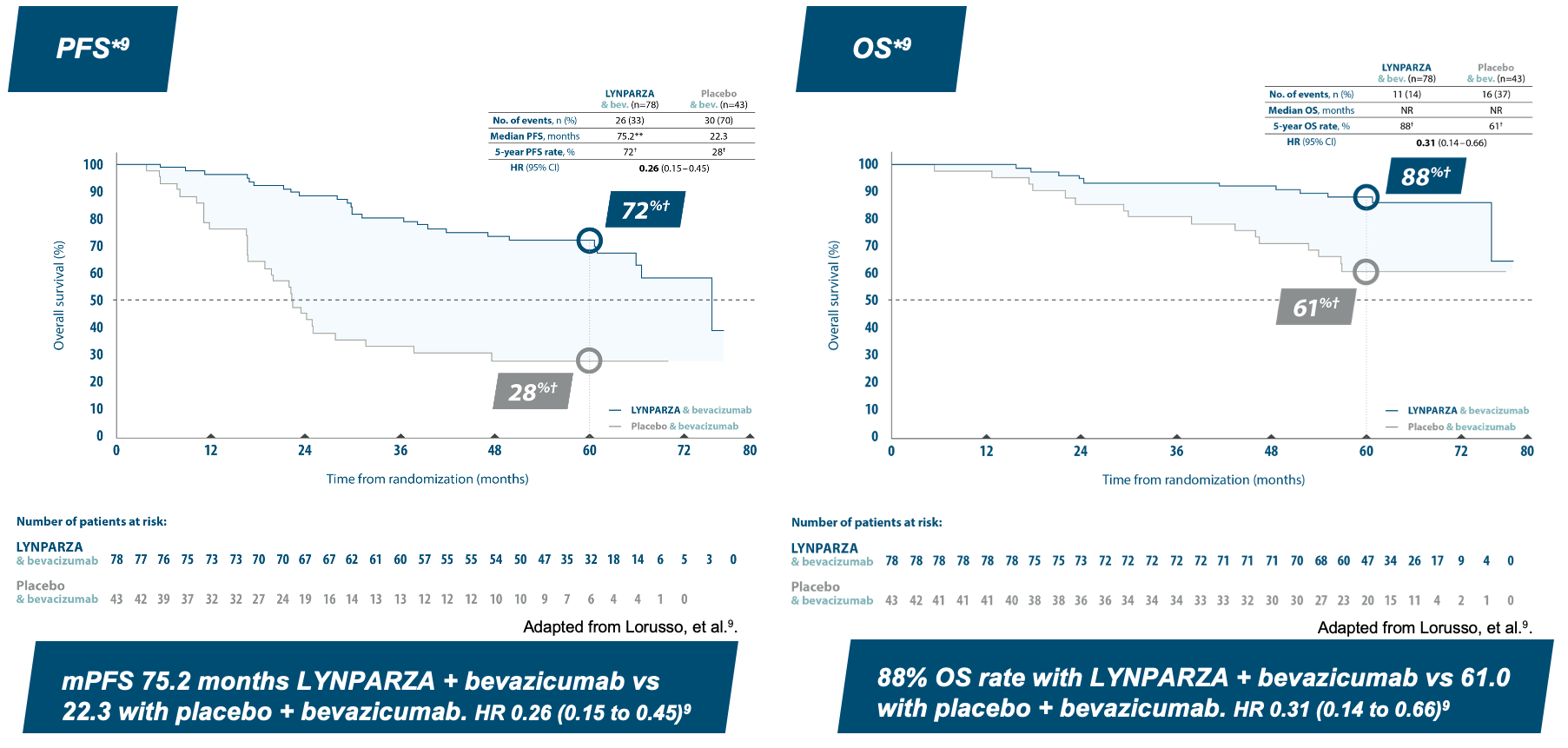
*Lower risk defined as FIGO Stage III patients with upfront surgery and complete resection. **Unstable median due to lack of events. †Kaplan-Meier estimates.
Consider PAOLA-1 regimen to all eligible HRD-positive patients for opportunity for long-term PFS and OS1,2
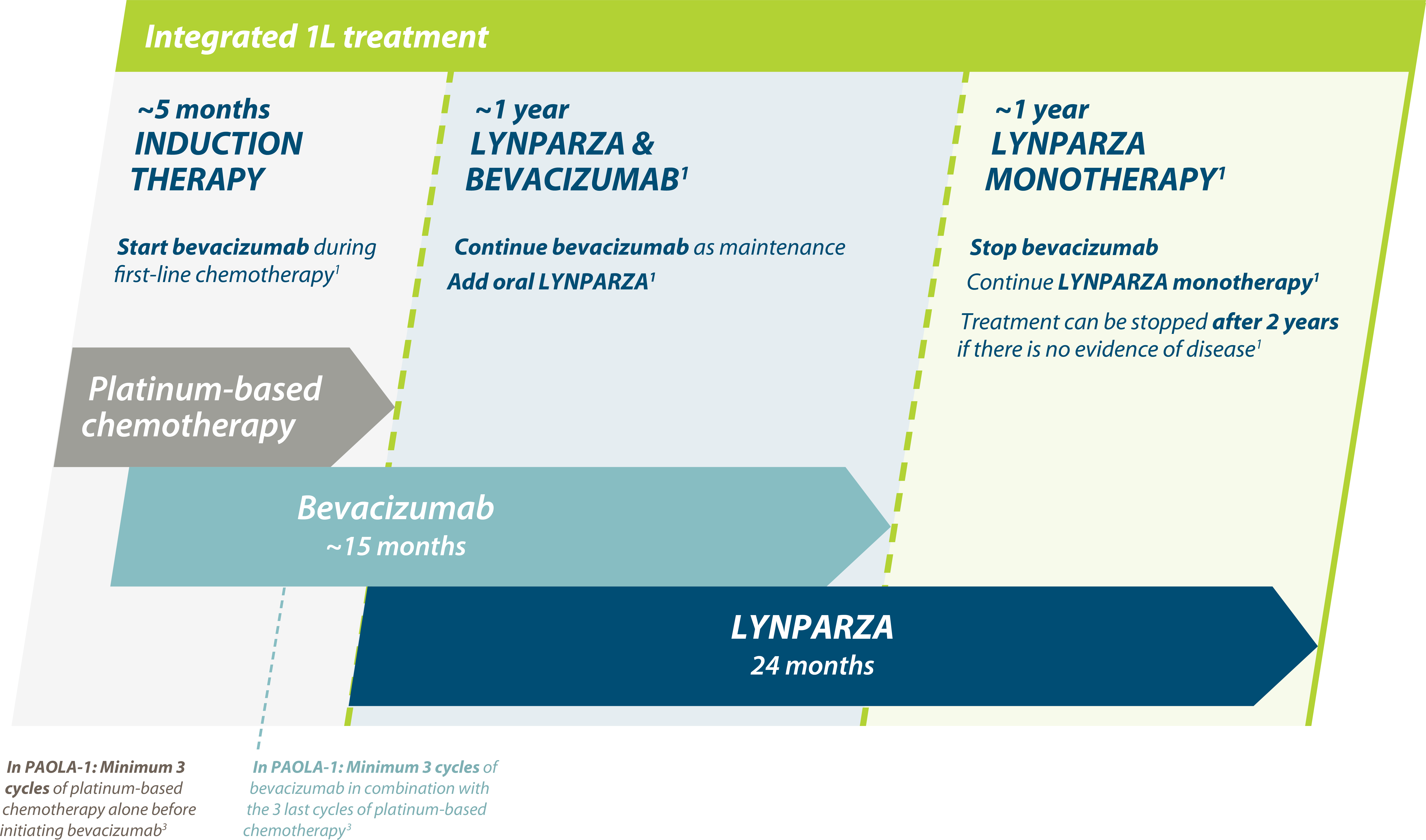
Adapted from Ray-Coquard, et al. 2019.2
Safety profile
Adverse events in PAOLA-1 were generally consistent with the known safety profiles of LYNPARZA and bevacizumab individually.
After 5-year-follow-up no new safety signals were observed and MDS/AML/AA, pneumonitis and new primary malignancy incidence remained low. The most common AEs of any grade were fatigue/nausea, hypertension, anemia and lymphopenia. And the most common grade ≥ 3 AE was anemia.
AEs were predominantly grade 1-2 and led to dose reduction in 41% with LYNPARZA+bevacizumab vs 7% with bevacizumab alone.2,5
Full safety information available in Lynparza SPC.
Lynparza in 1L advanced ovarian cancer
Below you can find information about Lynparza treatment and diagnostics in 1L advanced ovarian cancer.
Viktig informasjon Lynparza
LYNPARZA®(olaparib) er en potent hemmer av humane poly (ADP-ribose) polymerase (PARP-1, PARP-2 og PARP-3)-enzymer. Hemmer veksten av selekterte tumorcellelinjer in vitro og tumorvekst in vivo, enten som eneste behandling eller i kombinasjon med etablerte kjemoterapier.
Ovarialkreft: Lynparza er indisert som monoterapi til: Vedlikeholdsbehandling av voksne pasienter med avansert (FIGO trinn III og IV) BRCA1/2- mutert (kimbanen og/eller somatisk) høygradig kreft i ovarieepitel, eggleder eller primær peritoneal kreft som responderer (fullstendig eller delvis) etter avsluttet førstelinje platinabasert kjemoterapi. Vedlikeholdsbehandling av voksne pasienter med tilbakefall av platinasensitiv høygradig kreft i ovarieepitel eller eggleder eller primær peritoneal kreft som responderer (fullstendig eller delvis) på platinabasert kjemoterapi.
Lynparza i kombinasjon med bevacizumab er indisert til: Vedlikeholdsbehandling av voksne pasienter med avansert (FIGO trinn III og IV) høygradig kreft i ovarieepitel, eggleder eller primær peritoneal kreft som responderer (fullstendig eller delvis) etter avsluttet førstelinje platinabasert kjemoterapi i kombinasjon med bevacizumab, og hvor kreften er forbundet med defekt homolog rekombinasjon (HRD)-positiv status definert av enten en BRCA1/2 mutasjon og/eller genomisk ustabilitet, (se pkt. 5.1 i SPC).
DOSERING OG ADMINISTRASJONSMÅTE. Behandling med Lynparza bør initieres og overvåkes av lege med erfaring i bruk av legemidler til kreftbehandling. Anbefalt dose av Lynparza som monoterapi eller i kombinasjon med bevacizumab for ovarialkreft er 300 mg (to tabletter à 150 mg) som skal tas to ganger daglig, tilsvarende en daglig dose på totalt 600 mg. Tablett à 100 mg er tilgjengelig for dosereduksjon. Ved bruk av Lynparza i kombinasjon med bevacizumab til behandling av pasienter med høygradig kreft i ovarieepitel, eggleder eller primær peritoneal kreft er dosen med bevacizumab 15 mg/kg én gang hver 3. uke. Vennligst se fullstendig produktinformasjon for bevacizumab (se pkt. 5.1 i SPC).
KONTRAINDIKASJONER: Amming under behandling og i 1 måned etter den siste dosen (se pkt. 4.6 i SPC).
FORSIKTIGHET UTVISES VED:
Hematologisk toksisitet: Blodtelling før behandlingsoppstart og deretter månedlig, er anbefalt de første 12 månedene av behandlingen og periodevis etter dette tidspunktet for å overvåke klinisk signifikante endringer av verdiene under behandling.
Myelodysplastisk syndrom/akutt myelogen leukemi: Dersom MDS og/eller AML blir diagnostisert under behandling med Lynparza, skal Lynparza seponeres og pasienten skal få hensiktsmessig behandling.
Venøse tromboemboliske hendelser: Pasientene skal overvåkes med tanke på kliniske tegn og symptomer på venetrombose og lungemboli og behandles på medisinsk hensiktsmessig måte.
Pneumonitt: Hvis pasienten får nye, eller en forverring av respiratoriske symptomer som dyspné, hoste og feber, eller et unormalt radiologisk funn observeres i brystet, bør behandling med Lynparza avbrytes og utredning igangsettes raskt.
Levertoksisitet: Dersom det utvikles kliniske symptomer eller tegn som tyder på levertoksisitet, må klinisk vurdering av pasienten og måling av leverfunksjonsprøver utføres raskt. Dersom det mistenkes legemiddelutløst leverskade (DILI), skal behandlingen avbrytes.
Fertilitet, graviditet: Fertile kvinner må ikke bli gravide når Lynparza benyttes og må ikke være gravide ved oppstart av behandlingen. Graviditetstesting bør utføres før oppstart av behandling og deretter regelmessig under behandling på alle fertile kvinner. Effekten av noen hormonelle legemidler kan reduseres ved samtidig administrasjon med Lynparza. En ekstra ikke-hormonell prevensjonsmetode bør derfor vurderes under behandling. Fertile kvinner må bruke to former for sikker prevensjon før oppstart av behandling med Lynparza, under behandlingen og i 6 måneder etter siste dose med Lynparza. Mannlige pasienter må bruke kondom og deres fertile kvinnelige partnere skal bruke sikker prevensjon under behandling og i 3 måneder etter å ha fått siste dose av Lynparza (se pkt. 4.6 i SPC).
VIKTIGE INTERAKSJONER: Samtidig administrering av Lynparza med kraftige eller moderate CYP3A-hemmere eller CYP3A-induktorer anbefales ikke. Se pkt. 4.2 og 4.5 i SPC for mer informasjon dersom en kraftig eller moderat CYP3A-hemmer eller CYP3A-induktor likevel må administreres samtidig med Lynparza.
VIKTIGE BIVIRKNINGER: De hyppigste observerte bivirkningene på tvers av kliniske studier hos pasienter som fikk Lynparza som monoterapi (≥ 10 %) var kvalme, oppkast, diaré, dyspepsi, fatigue/asteni, hodepine, dysgeusi, nedsatt appetitt, svimmelhet, hoste, dyspné, anemi, nøytropeni, , og leukocytopeni.
PRIS, FINANSIERING OG FORSKRIVNINGSREGLER
Pakninger og priser: Tabletter: 100 mg: 56 stk. kr 27754,60. 150 mg: 56 stk. kr 27754,60. Reseptgruppe C. H-resept.
Lynparza inngår i de regionale helseforetakenes anbefalinger for onkologiske legemidler, og rekvirering skal gjøres i tråd med disse: https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi/.
Markedsføringsinnehaver: AstraZeneca AS, Karvesvingen 7, 0579 Oslo, tel. 21006400
Før forskrivning av LYNPARZA, se FK-tekst eller SPC på www.felleskatalogen.no
AstraZeneca and MSD have an alliance regarding the product Lynparza.
NO-13233-11-24-ONC
References:
-
Lynparza SPC
-
Ray-Coquard I, et al. N Engl J Med. 2019;381:2416–28.
-
Gambara G, Gaebler M, Keiholz U, et al. From Chemotherapy to Combined Targeted Therapeutics: In Vitro and vivo Models to Decipher Intra-tumor Heterogenety. Front Pharmacol. 2028 Feb 14;9:77. Doi: 10.3389/fphar.2018.00077.
-
Saux OL, Vanacker H, Guermazi F, et al. Poly (ADP-ribose) polymerase inhibitors in combination with anti-angiogenic cancer. Future Oncol. 2021. Mar 17. Doi:10.2217/fon-2021-0059
-
Ray-Coquard I, et al. Ann Oncol. 2023;34(8):681-92).
-
Giornelli GH et al. Management of relapsed ovarian cancer: A review. SpringerPlus. 2016;5:1197.
-
du Bois A, et al. Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer: a combined exploratory analysis of 3 prospectively randomized phase 3 multicenter trials.Cancer.
-
Lorusso D, et al. Int J Gynecol Cancer. 2024;34:550-8
-
Lorusso D, et al. Int J Gynecol Cancer 2023;0:1–9. doi:10.1136/ijgc-2023-004995



