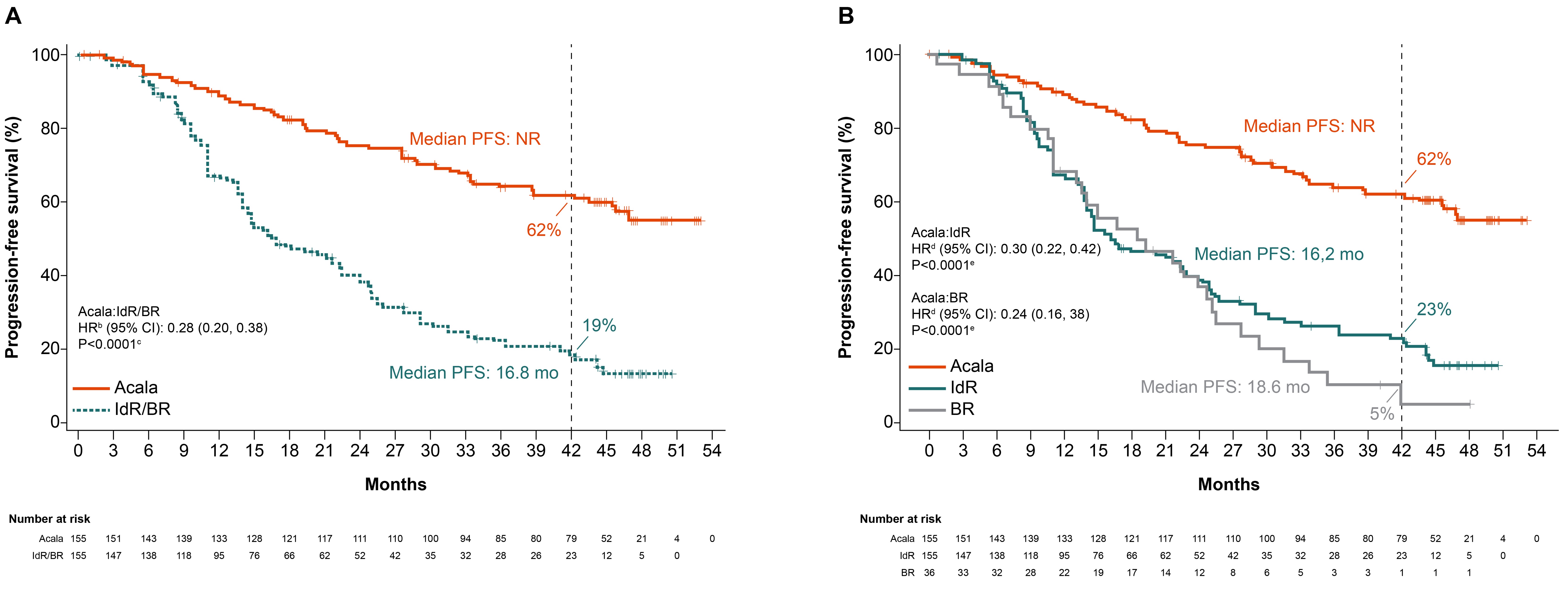
Godkjenningen av Calquence er basert på to randomiserte fase III-studier: ELEVATE-TN hos behandlingsnaive pasienter og ASCEND hos pasienter med tilbakefall og/eller refraktær KLL5.
ELEVATE-TN (n=535) er en åpen, randomisert fase III-studie som evaluerer sikkerheten og effekten av Calquence med eller uten obinutuzumab sammenlignet med obinutuzumab pluss klorambucil hos pasienter med behandlingsnaiv KLL. Ved den første analysen av studien var median oppfølgingstid 28,3 måneder (kvartilt intervall 25,6–33,1)6.
Median progresjonsfri overlevelse var signifikant lengre med Calquence-obinutuzumab (A+O) (ikke oppnådd, 95 % konfidensintervall KI, ikke målbart) enn med obinutuzumab-klorambucil (O+Clb) (22,6 måneder, 95 % KI 20,2–27,6), med en 90 % reduksjon i relativ risiko for progresjon eller død med Calquence-obinutuzumab (HR 0,10, 0,06–0,17; p <0,0001)6. Median progresjonsfri overlevelse var også signifikant lengre med Calquence monoterapi (ikke oppnådd, intervall 34,2 – ikke målbart) versus obinutuzumab-klorambucil (22,6, 95 % KI 20,2–27,6) med en 80 % relativ reduksjon i risikoen for progresjon eller død (HR 0,20, 95 % KI 0,13–0,30; p <0,0001)6.
Langtidsdata for CALQUENCE® (akalabrutinib) – 6 års oppfølging
På ASH 2023 ble data fra ELEVATE-TN-studien med 74,5 måneders oppfølging presentert7.
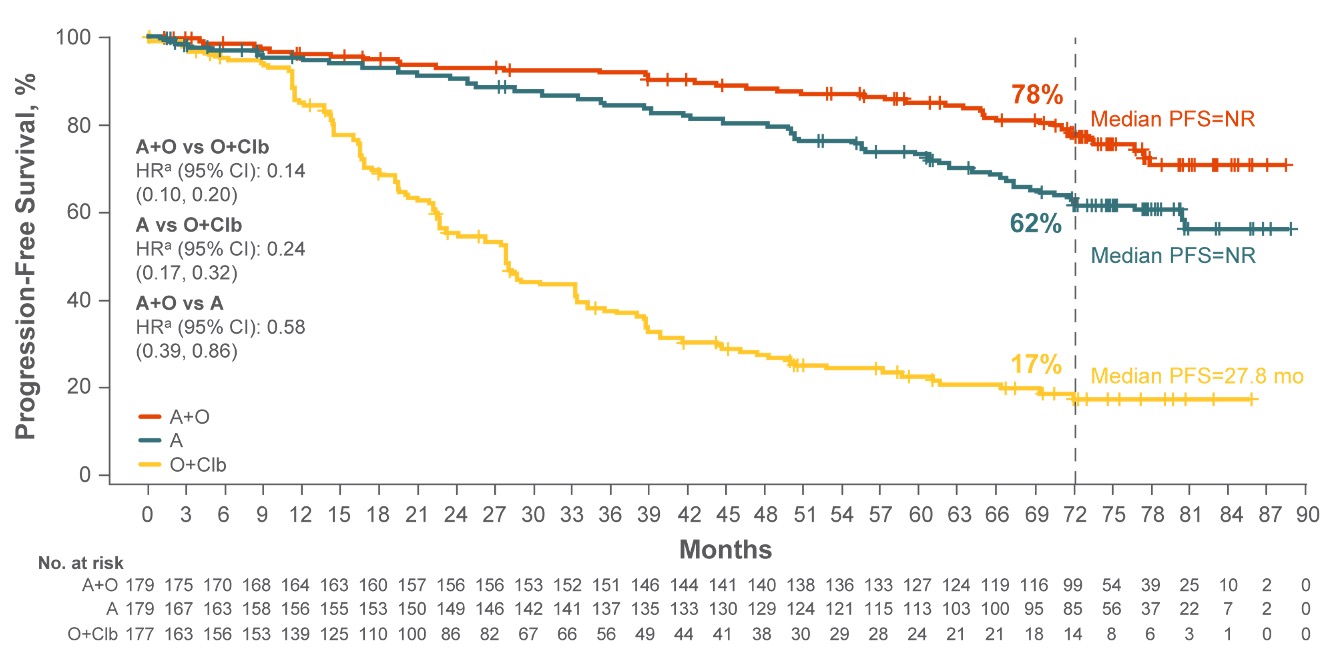
Tilpasset fra Sharman P. et al. Blood. 2025. blood.2024024476
† Estimert PFS ved 72 månader7.
Etter 6 år viste Calquence + obinutuzumab en redusert risiko for sykdomsprogresjon eller død sammenlignet med obinutuzumab + klorambucil-armen, (HR 95 % KI: 0,14 (0,10, 0,20); P < 0,0001)7. Median progresjonsfri overlevelse forble signifikant lengre med Calquence + obinutuzumab (ikke oppnådd) enn med obinutuzumab + klorambucil (27,8 måneder)4. Median progresjonsfri overlevelse var også signifikant lengre med Calquence monoterapi (ikke oppnådd) sammenlignet med obinutuzumab + klorambucil (27,8 måneder) for progresjon eller død, (HR 95 % KI): 0,24 (0,17, 0,32), P < 0,00017.
De vanligste bivirkningene av grad ≥ 3 var nøytropeni, COVID-19, trombocytopeni, pneumoni, anemi, diaré, synkope7.
Hvis du ønsker å lese ELEVATE-TN-studien i sin helhet, vennligst bestill ELEVATE-TN-studien her.