▼ Enhertu (trastuzumabderukstekan)
Dette legemidlet er underlagt særlig overvåking. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning.
Enhertu (trastuzumabderukstekan)
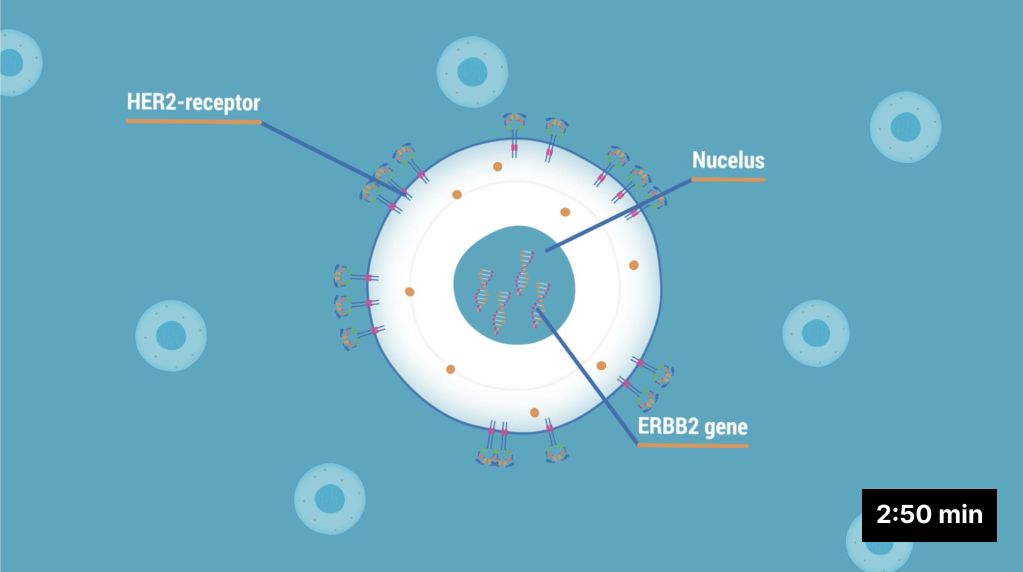
Indikasjon: Brystkreft: HER2-positiv brystkreft: som monoterapi til behandling av voksne pasienter med inoperabel eller metastaserende HER2-positiv brystkreft som har fått ett eller flere tidligere anti-HER2-baserte regimer. HER2-lav brystkreft: som monoterapi til behandling av voksne pasienter med inoperabel eller metastaserende HER2-lav brystkreft som har fått tidligere kjemoterapi ved metastaserende sykdom eller fått sykdomstilbakefall under eller innen 6 måneder etter fullført adjuvant kjemoterapi (se pkt. 4.2 i preparatomtale). Ikke-småcellet lungekreft (NSCLC): som monoterapi til behandling av voksne pasienter med avansert NSCLC der tumorene har en aktivert HER2 (ERBB2)-mutasjon og som behøver systemisk behandling etter platinumbasert kjemoterapi med eller uten immunterapi. Ventrikkelkreft: som monoterapi til behandling av voksne pasienter med avansert HER2-positivt adenokarsinom i ventrikkel eller gastroøsofageal overgang (GEJ) som tidligere har fått ett trastuzumab-basert regime.
Dosering: Anbefalt dose brystkreft og ikke-småcellet lungekreft (NSCLC): 5,4 mg/kg. Anbefalt dose ventrikkelkreft: 6,4 mg/kg. Gis som iv. infusjon (ikke som støtdose eller bolus) 1 gang hver 3. uke (21-dagerssyklus) frem til sykdomsprogresjon eller uakseptabel toksisitet. Før hver dose bør pasientene premedisineres med et kombinasjonsregime av 2 eller 3 legemidler for å forebygge kvalme og oppkast (f.eks. deksametason med enten en 5-HT3-reseptorantagonist og/eller en NK1-reseptorantagonist, samt andre legemidler som indisert) til forebygging av kjemoterapiindusert kvalme og oppkast.
Bivirkninger: De vanligste bivirkningene var kvalme (75,0 %), fatigue (57,3 %) og oppkast (42,1 %),. Behandling av bivirkninger kan kreve midlertidig avbrudd, dosereduksjon eller seponering av behandling.
Utvalgt sikkerhetsinformasjon: Skal forskrives av lege og administreres under tilsyn av helsepersonell med erfaring innen bruk av kreftlegemidler. For å forebygge feilmedisinering skal hetteglassene sjekkes for å sikre at legemidlet som tilberedes og administreres er Enhertu (trastuzumabderukstekan) og ikke trastuzumab eller trastuzumabemtansin.
Interstitiell lungesykdom (ILD)/pneumonitt: Pasienter skal monitoreres for tegn og symptomer på ILD/pneumonitt og umiddelbart utredes ved mistanke om dette. Nøytropeni: Komplett blodtelling skal foretas før oppstart av behandling og før hver dose, og som klinisk indisert.
Reduksjon i venstre ventrikkels ejeksjonsfraksjon (LVEF): Standard hjertefunksjonsundersøkelse (EKG eller MUGA‑skanning) skal foretas for å vurdere LVEF før oppstart av behandling og regelmessig under behandling som klinisk indisert. Graviditet: Kan forårsake fosterskade.
Vi anbefaler at du leser preparatomtalen før oppstart av behandling. Det er utarbeidet risikohåndteringsmateriell og pasientinformasjon for Enhertu. Dette finner du på www.felleskatalogen.no eller ved å kontakte oss.
Se preparatomtalen (SPC) for utfyllende informasjon om Enhertu.
Reseptgruppe: C.
Pakninger og priser: 100mg: 1 stk. (hetteglass) 22341,00 NOK.
Enhertu markedsføres i Norge av Daiichi Sankyo Nordics Aps og AstraZeneca AS.
Daiichi Sankyo Nordics ApS, Amagerfælledvej 106, 2300 København S
T: +45 88 44 45 45
www.nordics.daiichi-sankyo.eu
AstraZeneca AS, Karvesvingen 7. 0759 Oslo
T: +47 21 00 64 00
www.astrazeneca.no
NO/ENH/03/24/0001 11.01.24