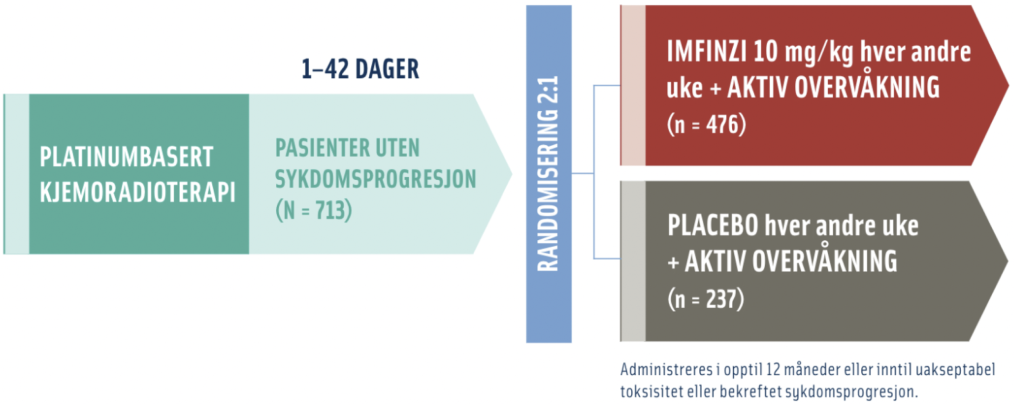
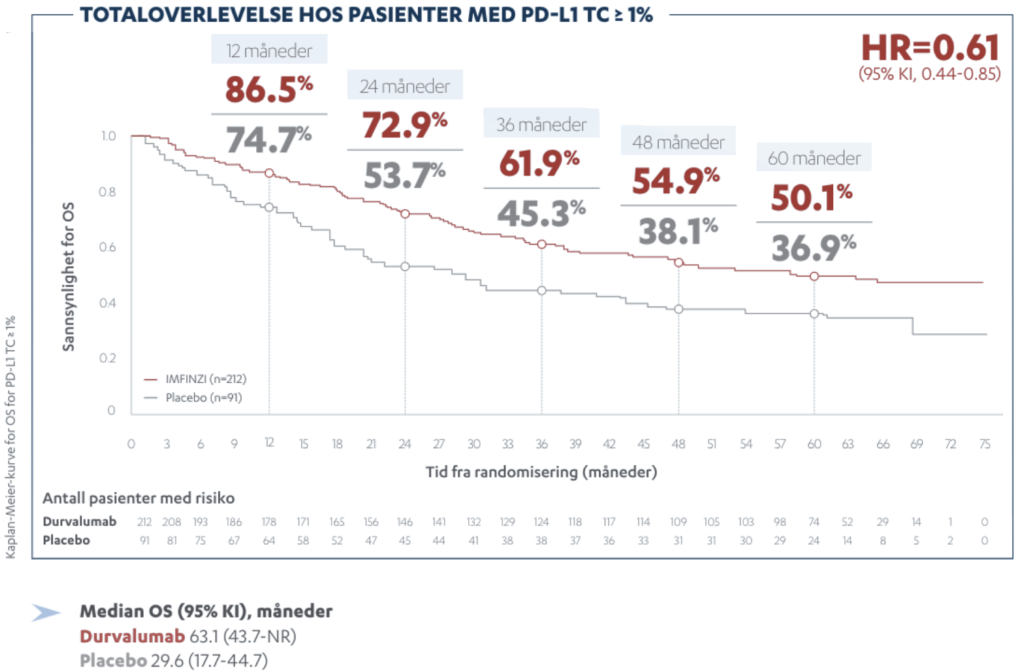
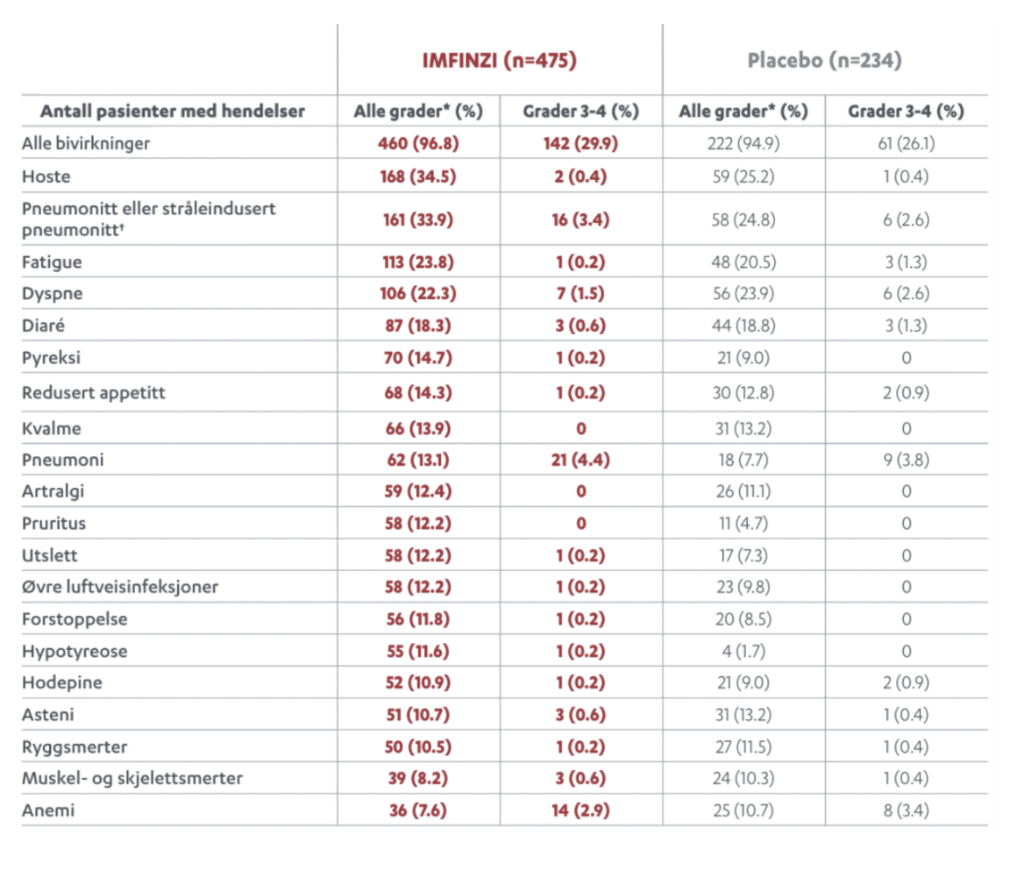
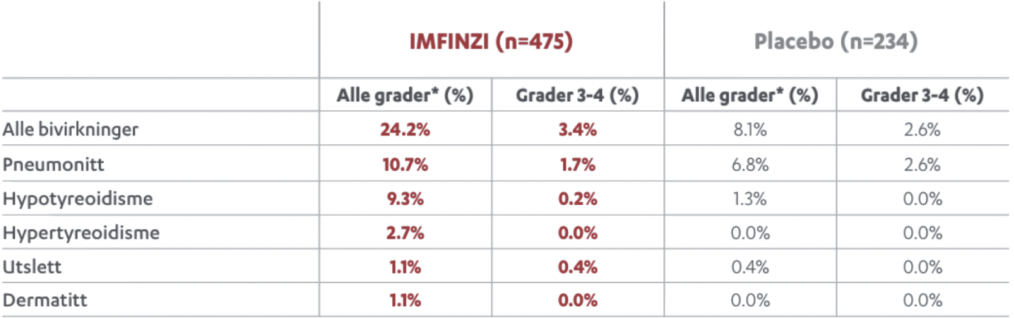
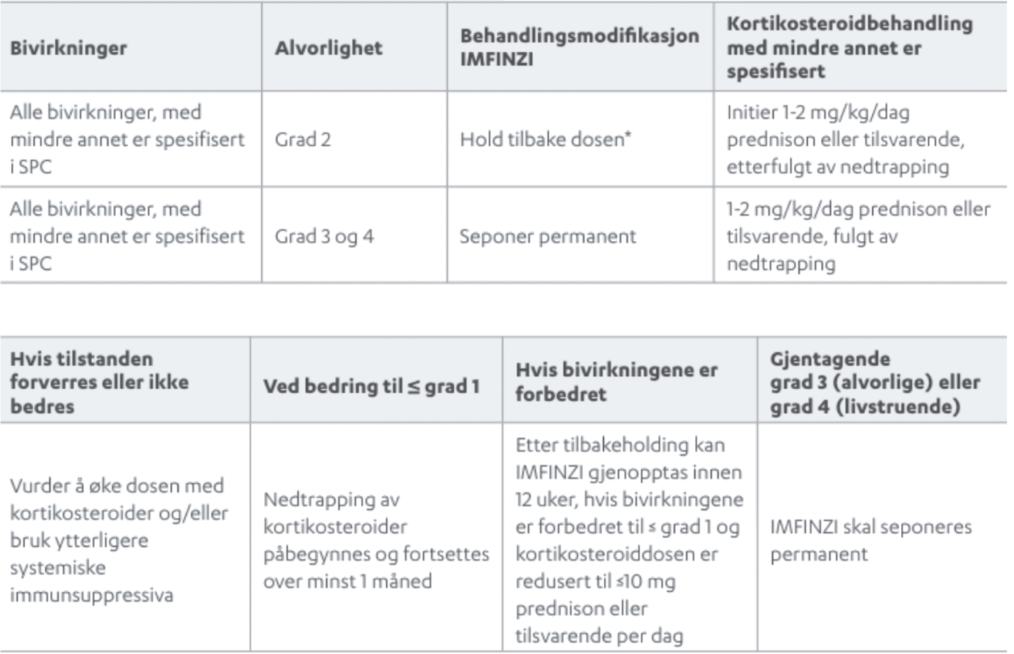
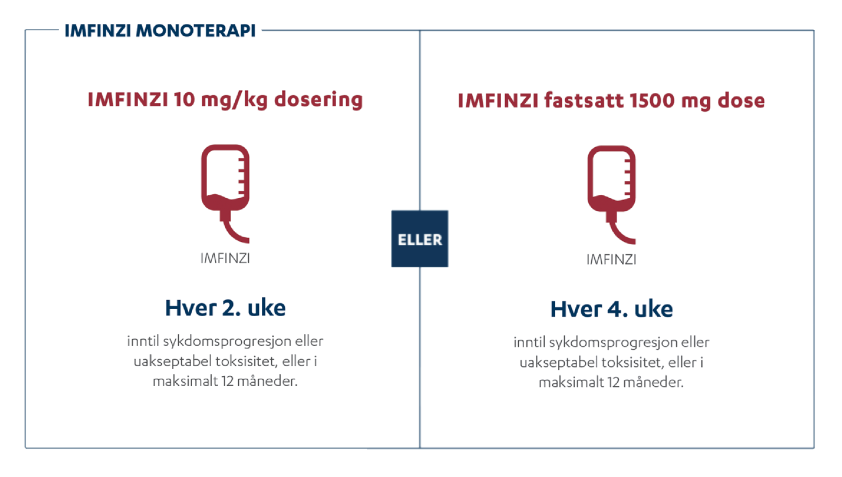
PACIFIC studien er den største studien utført på IMFINZI ved inoperabel stadium III ikke-småcellet lungekreft. Studien er nå oppdatert med 5 års oppfølgingsdata. I denne animasjonsfilmen går vi igjennom PACIFIC studien på IMFINZI.
NO-11313
* I henhold til Staging Manual in ThoracicOncology, versjon 7, av the International Association for theStudyofLung Cancer. Figur utviklet av AstraZeneca basert på tekst i Ref.1.